- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Clinical Study(潰瘍性大腸炎)「寛解導入期」に対する効果 安全性
 Clinical Study(潰瘍性大腸炎)「寛解導入期」に対する効果
Clinical Study(潰瘍性大腸炎)「寛解導入期」に対する効果
安全性
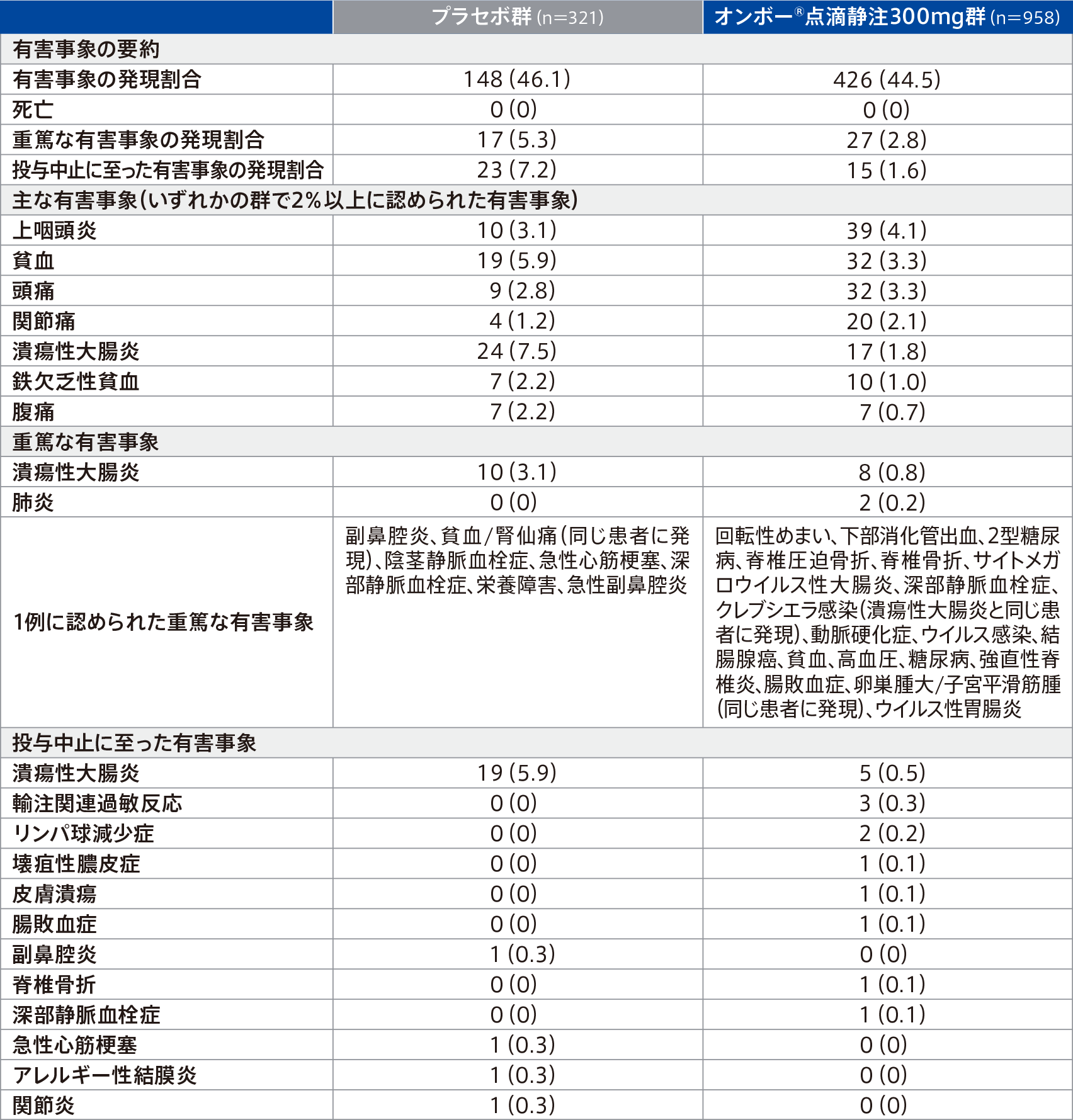
寛解導入期での有害事象は、プラセボ群46.1%(148/321例)、オンボー®点滴静注300mg群44.5%(426/958例)に認められ、主な有害事象(いずれかの群で2%以上に認められた有害事象)は下表のとおりであった。
因果関係が否定できない有害事象は、プラセボ群10.9%(35/321例)、オンボー®点滴静注300mg群10.3%(99/958例)に認められ、4例以上に認められた因果関係が否定できない有害事象は、プラセボ群では潰瘍性大腸炎1.6%(5/321例)、頭痛1.2%(4/321例)、オンボー®点滴静注300mg群では頭痛1.4%(13/958例)、そう痒症0.8%(8/958例)、上咽頭炎0.6%(6/958例)、悪心0.5%(5/958例)、白血球減少症0.5%(5/958例)、関節痛0.5%(5/958例)、輸注関連過敏反応0.4%(4/958例)であった。
本試験において死亡は認められなかった。
重篤な有害事象は、プラセボ群5.3%(17/321例)、オンボー®点滴静注300mg群2.8%(27/958例)に認められ、その事象は下表のとおりであった。このうち、プラセボ群の潰瘍性大腸炎3例、副鼻腔炎1例及び陰茎静脈血栓症1例、オンボー®点滴静注300mg群の潰瘍性大腸炎1例、深部静脈血栓症1例及びクレブシエラ感染1例は、治験薬との因果関係ありと判断された。
投与中止に至った有害事象は、プラセボ群7.2%(23/321例)、オンボー®点滴静注300mg群1.6%(15/958例)に認められ、その事象は下表のとおりであった。
例数(%)(1例に認められた重篤な有害事象以外)