- 医療関係者向けホーム
- 産婦人科領域
- ディナゲスト
- ディナゲスト錠・OD錠1mg
- Clinical Study:国内第Ⅲ相二重盲検比較試験〈24週間投与〉(非劣性試験)(子宮内膜症) 安全性
 Clinical Study国内第Ⅲ相二重盲検比較試験〈24週間投与〉(非劣性試験)(子宮内膜症)
Clinical Study国内第Ⅲ相二重盲検比較試験〈24週間投与〉(非劣性試験)(子宮内膜症)
安全性
主要評価項目
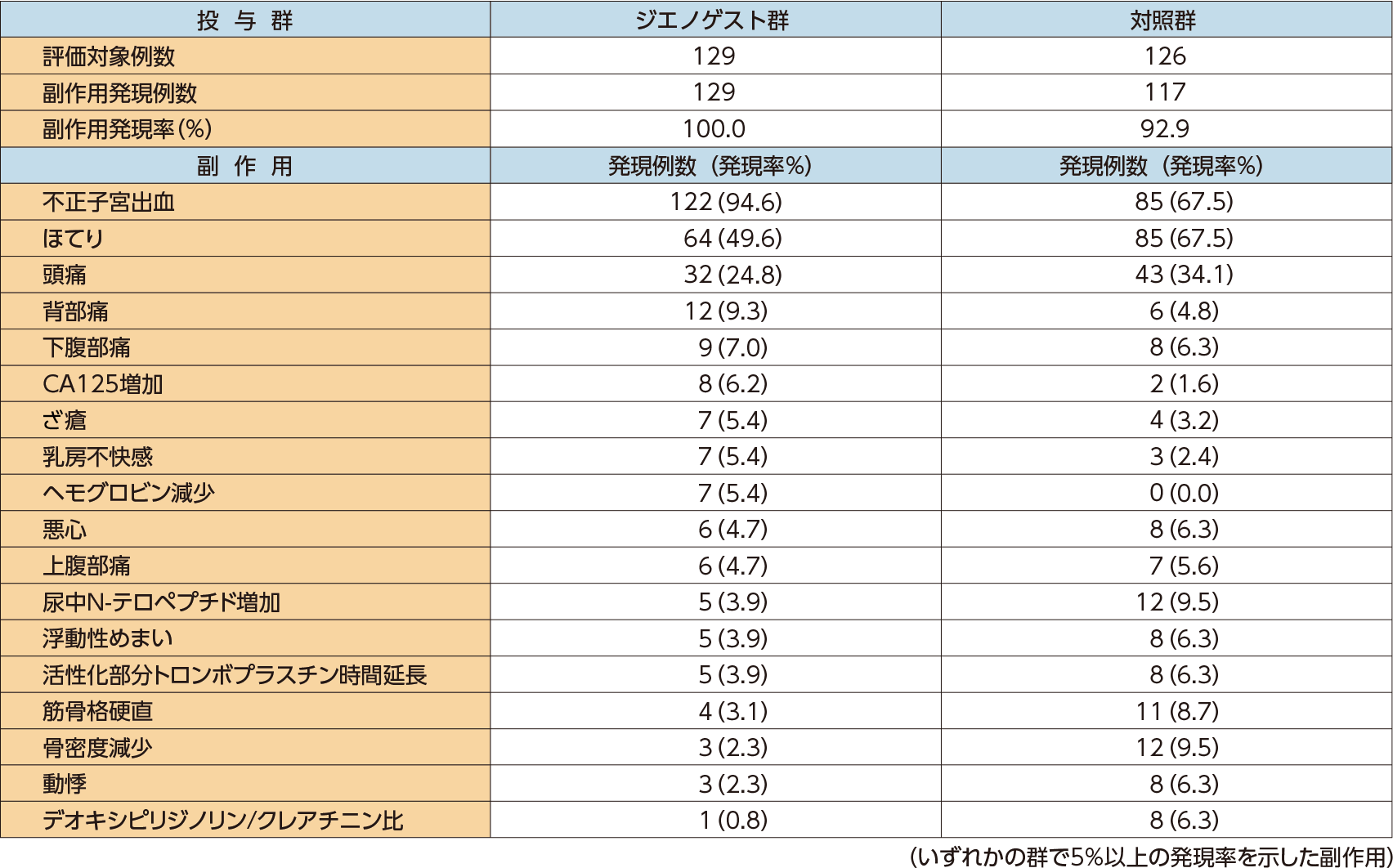
副作用発現率
ジエノゲスト群の副作用は129例中129例(100%)に認められた。主な副作用は不正子宮出血(94.6%)、ほてり(49.6%)、頭痛(24.8%)、背部痛(9.3%)、下腹部痛(7.0%)、CA125増加(6.2%)、ざ瘡、乳房不快感、ヘモグロビン減少(各5.4%)などであった。
対照群の副作用は126例中117例(92.9%)に認められた。主な副作用は不正子宮出血、ほてり(各67.5%)、頭痛(34.1%)、尿中N-テロペプチド増加、骨密度減少(各9.5%)、筋骨格硬直(8.7%)、下腹部痛、悪心、浮動性めまい、活性化部分トロンボプラスチン時間延長、動悸、デオキシピリジノリン/クレアチニン比(各6.3%)、上腹部痛(5.6%)などであった。
本試験において、死亡例は認められなかった。重篤な副作用がジエノゲスト群で1例(腹膜炎)、対照群で1例(出血性卵巣嚢胞)認められ、ジエノゲスト群1例については投与中止した。その他の投与中止に至った副作用はジエノゲスト群で5例(脱毛症、狭心症、亜急性甲状腺炎、異常感及びほてり、蕁麻疹)、対照群で5例(動悸及び胸部不快感、ほてり、嘔吐及びほてり、面皰、円形脱毛症)認められた。
副次評価項目
骨密度の変化量(投与終了時:DXA[Dual-energy X-ray absorptiometry]測定)
投与前及び投与終了時の骨密度(mean±SD)は、ジエノゲスト群では各々1.0375±0.0858g/cm2、1.0274±0.0928g/cm2であり、対照群では1.0328±0.0928g/cm2及び1.0097±0.0977g/cm2であった。
投与前後の骨密度変化率(mean±SD)はジエノゲスト群で−1.015±2.337%(41例)、対照群で−2.558±2.337%(45例)であった。