- 医療関係者向けホーム
- 産婦人科領域
- ディナゲスト
- ディナゲスト錠・OD錠1mg
- Clinical Study:国内第Ⅲ相二重盲検比較試験〈16週間投与〉(子宮腺筋症) 試験の概要
 Clinical Study国内第Ⅲ相二重盲検比較試験〈16週間投与〉(子宮腺筋症)
Clinical Study国内第Ⅲ相二重盲検比較試験〈16週間投与〉(子宮腺筋症)
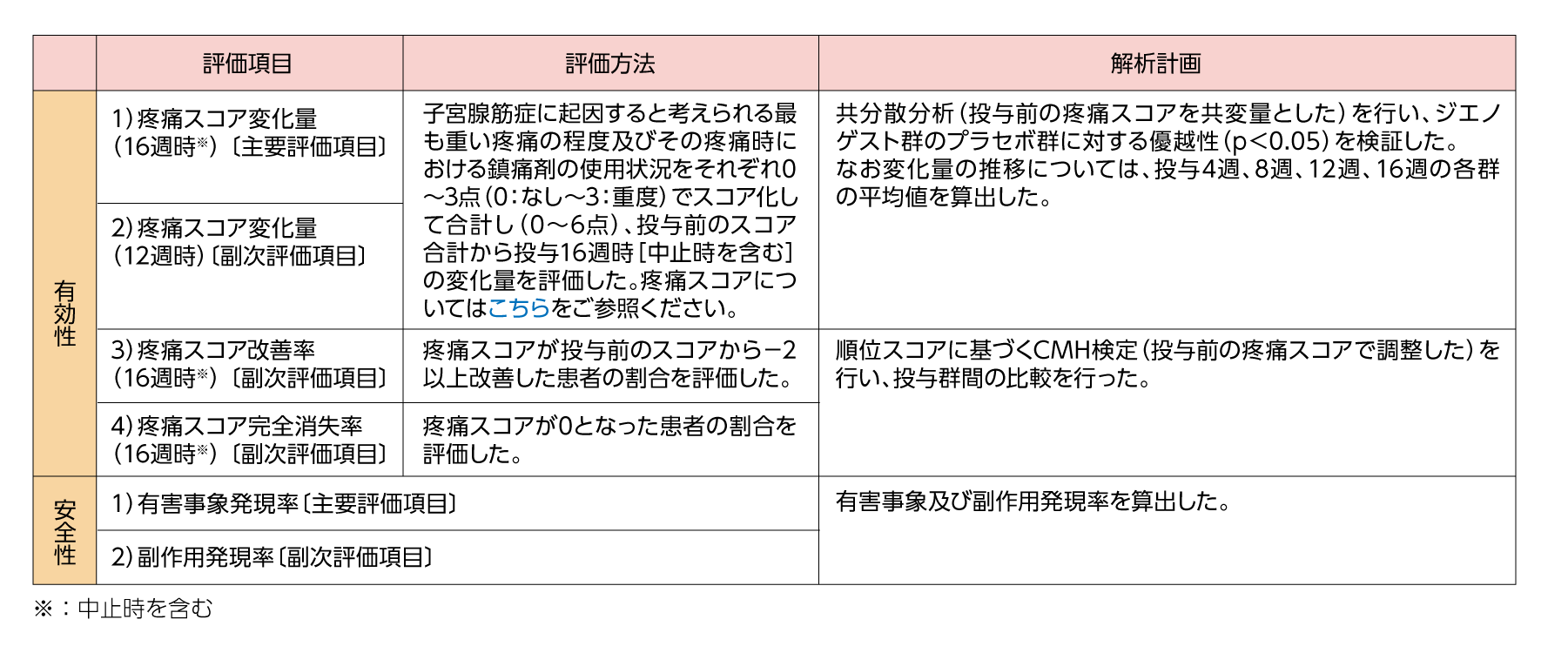
試験の概要「国内第Ⅲ相二重盲検比較試験〈16週間投与〉(子宮腺筋症)1、2)」
- 1)持田製薬社内資料 : 子宮腺筋症患者を対象とした第Ⅲ相試験
(2016年12月2日承認、CTD 5.3.5.1.3)〔承認時評価資料〕 - 2)Osuga, Y. et al.:Fertil. Steril. 2017;108(4):673-678
[利益相反]本研究は持田製薬株式会社の支援により行われた。著者のうち2名は持田製薬株式会社の社員である。
- 「禁忌を含む使用上の注意」等は添付文書をご参照ください。
試験デザイン
ランダム化二重盲検多施設共同プラセボ対照並行群間比較試験
目的
子宮腺筋症に伴う疼痛の改善に対するジエノゲスト2mg/日の有効性及び安全性について、プラセボを対照とした2群の比較試験により検討した。
対象
子宮腺筋症患者67例※1
- 同意取得日からVisit2(試験開始時から2週前を目安とした来院日)までの経腟超音波断層法及び16週以内のMRIにより子宮腺筋症と診断された患者
- 同意取得日からVisit2までの月経周期において、子宮腺筋症に起因すると考えられる疼痛(下腹痛又は腰痛)が疼痛スコアで3点以上の患者
疼痛スコア - 同意取得時の年齢が満20歳以上の患者
- 月経周期日数が38日以内の患者
- 本治験への参加を文書により同意した患者
- ※1:子宮内膜症もしくは子宮筋腫を合併する症例は除外した。
- ※2:「子宮体部の最大径が10cm(新生児頭大)以上又は子宮筋層最大厚4cm以上の患者」及び「ヘモグロビン値8.0g/dL未満の患者」を除外し、「ヘモグロビン値8.0g/dL以上11.0g/dL未満の患者」は本剤投与前に貧血に対する治療を実施し、ヘモグロビン値11.0g/dL以上に改善した症例のみを登録した。
ジエノゲスト群:34例(有効性解析対象:34例、安全性解析対象:34例)
プラセボ群:33例(有効性解析対象:33例、安全性解析対象:33例)
投与方法
ジエノゲスト群:ジエノゲスト2mg/日を1日2回に分け16週間経口投与。
プラセボ群:プラセボを1日2回に分け16週間経口投与。
各群とも月経周期2~5日目より投与を開始した。