- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害) 安全性
 Clinical Study第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害)
Clinical Study第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害)
安全性
有害事象
非盲検治療期において10%以上発現した有害事象は頭痛、悪心、倦怠感、浮動性めまい、多汗、不眠であった。
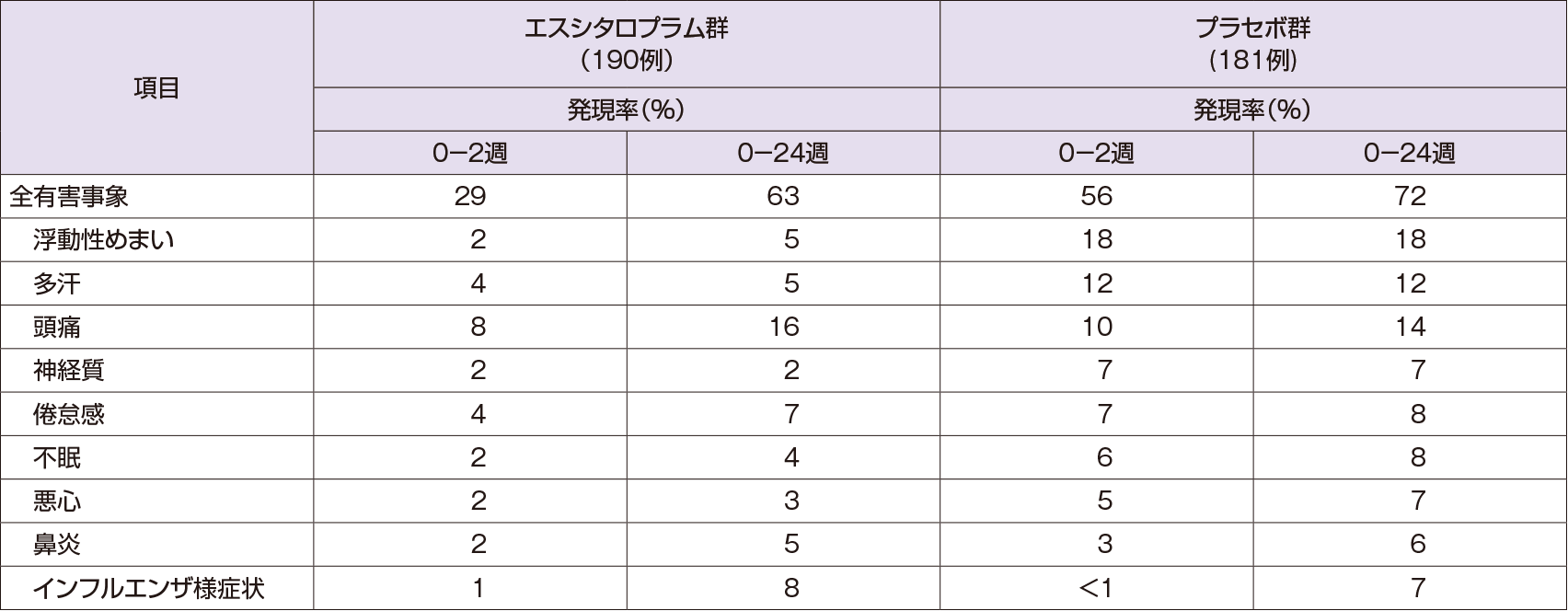
二重盲検治療期においていずれかの群で5%以上発現した有害事象は以下の通りであった。
- Montgomery SA, et al. A 24-week randomized, double-blind, placebo-controlled study of escitalopram for the prevention of generalized social anxiety disorder. The Journal of Clinical Psychiatry.66, 1270-1278, 2005. Copyright 2005, Physicians Postgraduate Press. Adapted by permission.
投与中止
非盲検治療期における中止例は、517例中86例(16.6%)にみられた。そのうち、有害事象による中止は48例(9.3%)で、その主なものは悪心10例、倦怠感7例、頭痛6例、浮動性めまい、不安が各5例であった。非盲検治療期の完了例431例のうち59例(13.7%)が治療継続不適格(非盲検治療期終了時のCGI-Iスコアが1又は2に該当しない)により二重盲検治療期のランダム化前に中止した。
二重盲検治療期における中止例は、エスシタロプラム群190例中25例(13.2%)、プラセボ群181例中15例(8.3%)であった。そのうち有害事象による中止例は、それぞれ5例(2.6%)、6例(3.3%)であった。