- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(肺動脈性肺高血圧症):国内第Ⅱ/Ⅲ相試験 試験の概要
 Clinical Study国内第Ⅱ/Ⅲ相試験(肺動脈性肺高血圧症)
Clinical Study国内第Ⅱ/Ⅲ相試験(肺動脈性肺高血圧症)
試験の概要「国内第Ⅱ/Ⅲ相試験1,2)(肺動脈性肺高血圧症)」
- 1)持田製薬社内資料:国内第Ⅱ/Ⅲ相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.8)<承認時評価資料>
- 2)Kuwana M, et al.: Pulm Circ. 2023; 13(1): e12198[利益相反:本試験は持田製薬株式会社の支援及びUnited Therapeutics社の編集補助により実施し、本論文の著者のうち2名は持田製薬株式会社の社員である]
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験デザイン
多施設共同、非盲検、非対照試験
目的
PAH患者におけるトレプロスチニルの有効性、安全性及び薬物動態を検討した。
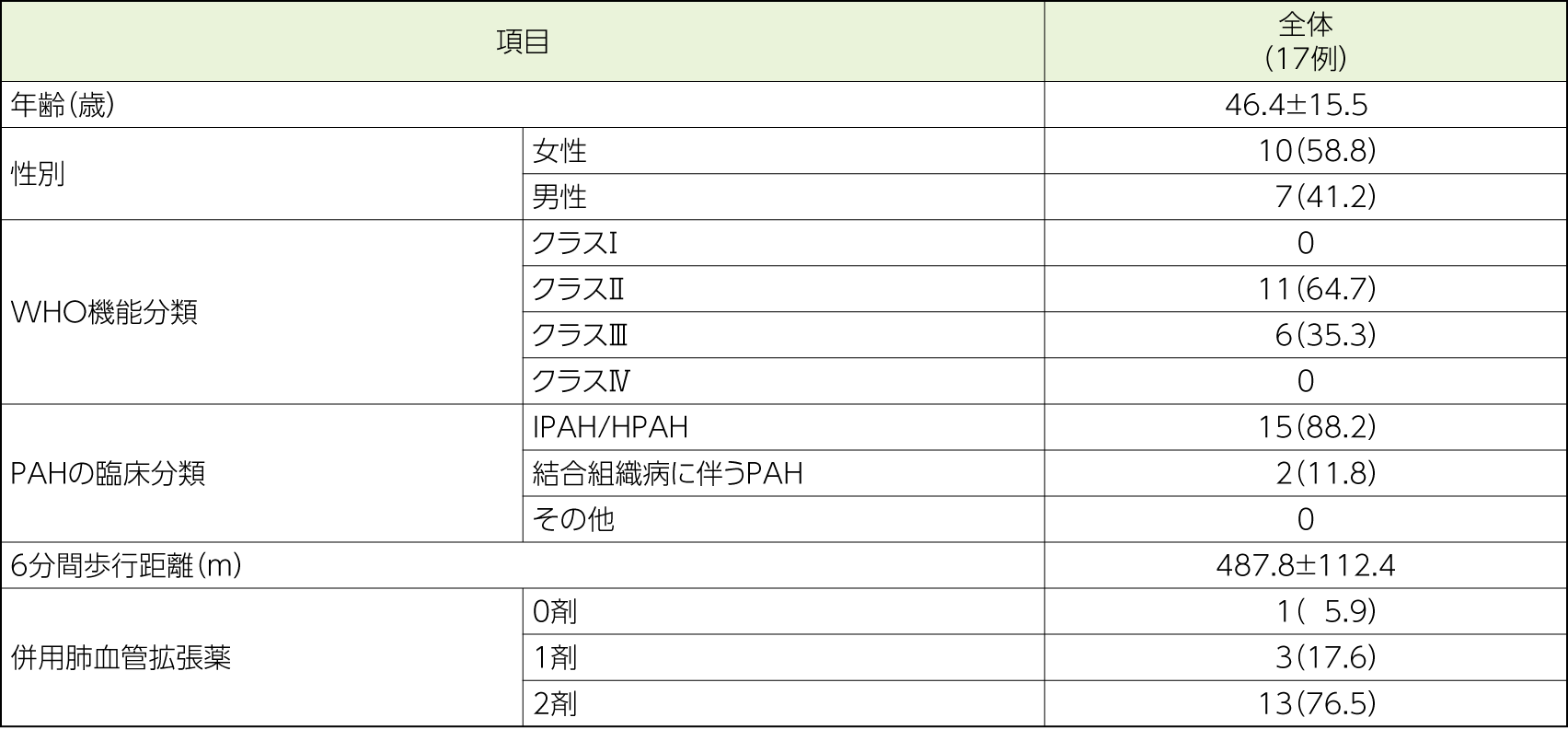
対象
PAH患者17例
- 再改訂版肺高血圧症臨床分類第1群のうち、以下に該当する患者
特発性肺動脈性肺高血圧症(IPAH)、遺伝性肺動脈性肺高血圧症(HPAH)、薬物・毒物誘発性肺動脈性肺高血圧症、結合組織病又はエイズウイルス感染症に伴う肺動脈性肺高血圧症 - 18歳以上75歳以下の男女
- 右心カテーテル検査の結果:安静時平均肺動脈圧≧25mmHg、肺動脈楔入圧≦15mmHg、肺血管抵抗≧5Wood単位(400dyn・sec/cm5)
- 6分間歩行距離≧200m
投与方法
トレプロスチニルを1日4回、1回1~9吸入(6~54μg)、52週間(患者が継続投与を希望する場合、トレプロスト吸入液の製造販売承認取得まで)TD-300ネブライザ※1を用いて吸入投与した。1回の吸入量は3吸入(18μg)から開始し、忍容性を確認しながら7日以上の間隔で1回3吸入ずつ漸増した。また、忍容性に問題があると判断した場合は1回の吸入量を減量することを可能とした。
- ※1 2022年9月付で、TD-300からTD-300/Jに名称が変更されました。
以下の併用を許容した。
- (1)エンドセリン受容体拮抗薬※2
- (2)ホスホジエステラーゼ-5阻害薬※2
- (3)可溶性グアニル酸シクラーゼ刺激薬※2
- (4)利尿薬※2
- (5)長期酸素療法(在宅酸素療法)
- (6)カルシウム拮抗薬※2
- (7)免疫抑制剤(経口投与)※2
- (8)副腎皮質ホルモン製剤(経口投与、静脈内投与、関節内投与、硬膜外投与)※2
- ※2 肺動脈性肺高血圧症の効能又は効果を有さないものを含む。
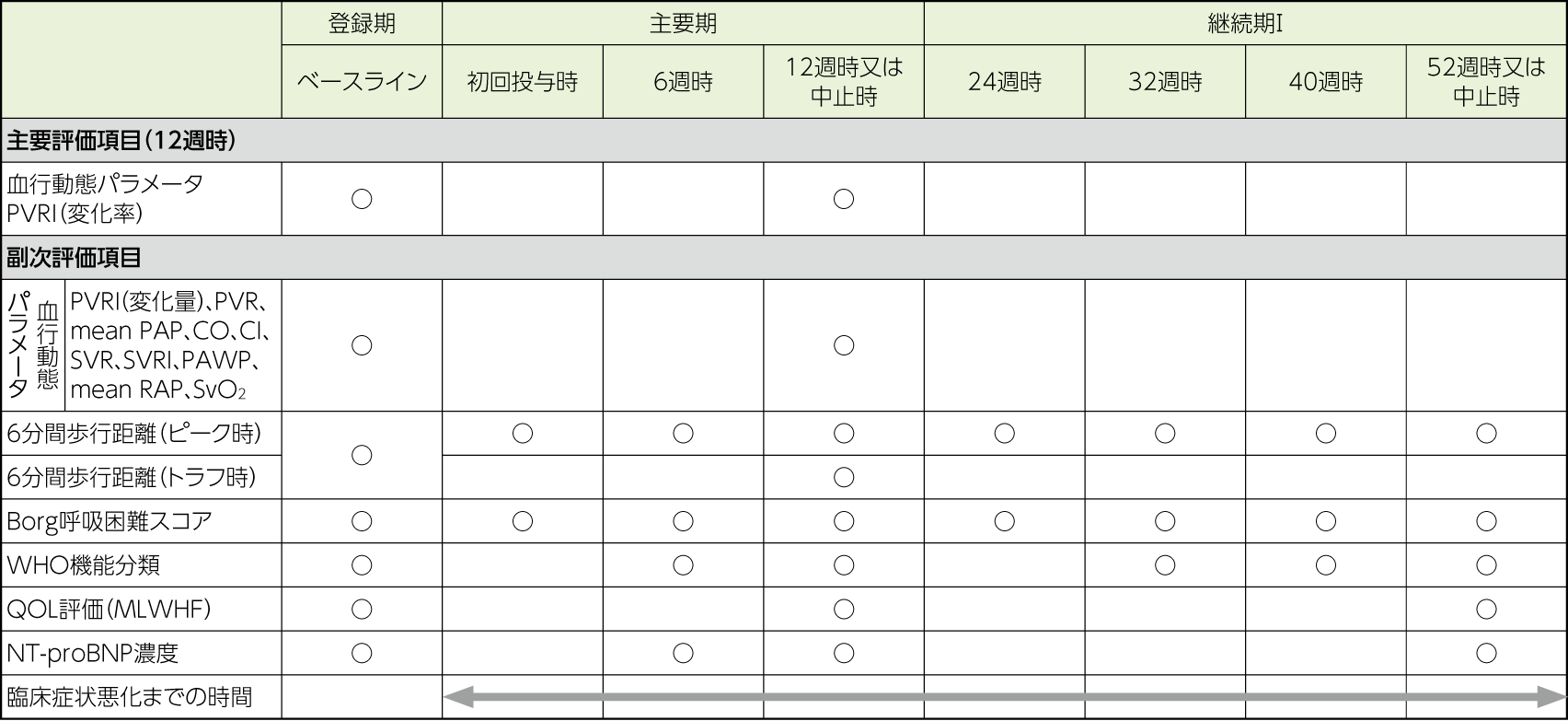
評価項目
- 安全性評価項目
有害事象(副作用)、他
略語一覧
- MLWHF:ミネソタ心不全質問票
- NT-proBNP:ヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント
- PVRI:肺血管抵抗係数
- PVR:肺血管抵抗
- mean PAP:平均肺動脈圧
- CO:心拍出量
- CI:心係数
- SVR:体血管抵抗
- SVRI:体血管抵抗係数
- PAWP:肺動脈楔入圧
- mean RAP:平均右心房圧
- SvO2:混合静脈血酸素飽和度
- IPAH:特発性肺動脈性肺高血圧症
- HPAH:遺伝性肺動脈性肺高血圧症
解析計画
有効性の主要な解析対象集団はFASとした。
主要評価項目では、12週時におけるPVRIのベースラインからの変化率について要約統計量及び平均値の両側95%信頼区間を算出した。なお、PVRIの値は12週時における投与後15分又は30分の測定値のうち、より低い値を最良値として評価に用いた。
副次評価項目では、要約統計量及び平均値の両側95%信頼区間を算出した。血行動態パラメータにおけるPVR、mean PAP、SVR、SVRI、PAWP及びmean RAPは、各患者における測定値又は算出値のうち、より低い値を最良値として評価に用いた。CO、CI及びSvO2は、各患者における測定値又は算出値のうち、より高い値を最良値として評価に用いた。6分間歩行距離については、登録期の値をピーク時/トラフ時ともにベースラインとして用いた。
WHO機能分類については各評価時期の測定値を用いた。
以下に定義する臨床症状悪化までの時間に基づきKaplan-Meierプロットを作成し、また、イベント発現割合及びその両側95%信頼区間を算出した。
- 死亡(原因は問わない)
- 肺移植を必要とするPAHの悪化
- PAHの悪化のための入院(検査、待機的手術、事故又は薬剤に関連した有害事象のための入院は該当しない)
- PAHに対する治療の追加(以下の薬剤の「使用開始」又は「使用のための試験の中止」)
- a. トレプロスト以外のプロスタサイクリン経路を標的とした薬剤
- b. エンドセリン受容体拮抗薬
- c. ホスホジエステラーゼ-5阻害薬
- d. 可溶性グアニル酸シクラーゼ刺激薬
安全性の解析対象集団(主要期、継続期I)として、当該期において治験薬を投与された患者、かつ当該期において安全性評価に関するデータがある患者と定めた。
2025年11月作成
17050-14/N6 60 GMJ