- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(間質性肺疾患に伴う肺高血圧症):国内第Ⅱ/Ⅲ相試験 安全性
 Clinical Study国内第Ⅱ/Ⅲ相試験(間質性肺疾患に伴う肺高血圧症)
Clinical Study国内第Ⅱ/Ⅲ相試験(間質性肺疾患に伴う肺高血圧症)
安全性
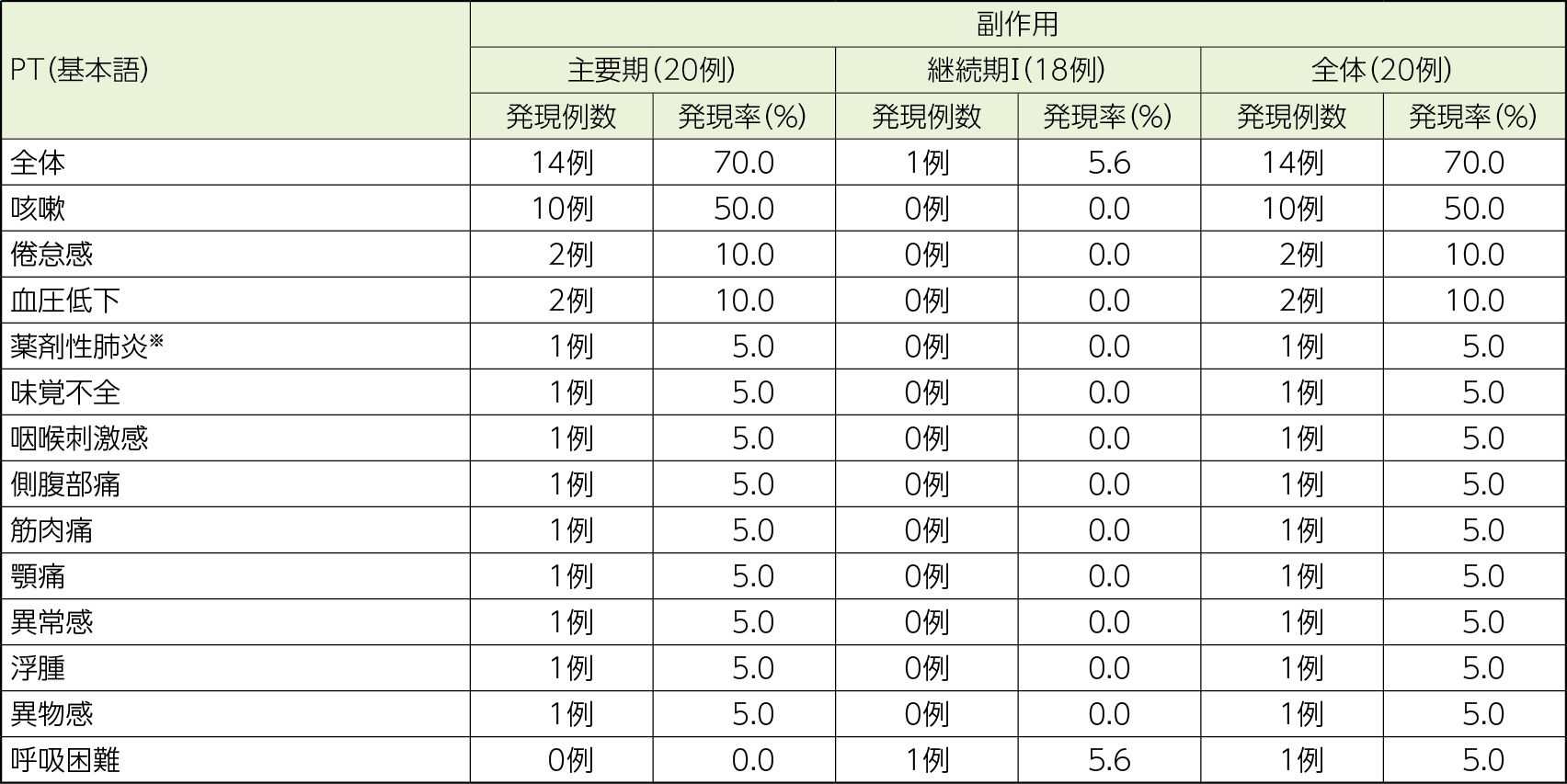
副作用
副作用の発現率は主要期において70.0%(14/20例)、継続期Ⅰにおいて5.6%(1/18例)、全体(主要期及び継続期Ⅰ)において70.0%(14/20例)であった。
全体(主要期及び継続期Ⅰ)において2例以上に認められた副作用は、咳嗽10例(50.0%)、倦怠感及び血圧低下各2例(10.0%)で、全て主要期で認められた副作用であった。
重篤な副作用は主要期において薬剤性肺炎※1例が認められ(投与中止により回復)、継続期Ⅰでは認められなかった。
投与中止に至った副作用は主要期において薬剤性肺炎※、咳嗽各1例、継続期Ⅰにおいて呼吸困難1例、全体(主要期及び継続期Ⅰ)において3例に認められた。
死亡に至った副作用は認められなかった。
- 用語辞書:MedDRA/J Ver.26.0
- ※医師記載名では「薬剤性肺炎の疑い」、MedDRA/J Ver.26.0では「肺炎」
呼吸機能検査
ベースラインのFVCの測定値(平均値±標準偏差)は2.04±0.72Lであった。8週時、16週時、24週時及び52週時におけるFVCの測定値のベースラインからの変化量(平均値±標準偏差)はそれぞれ0.03±0.15L、0.10±0.17L、0.08±0.16L及び0.03±0.31Lであった。
各評価時期におけるFEV1、TLC、DLCO及びDLCO/VAの測定値のベースラインからの変化量(平均値)はそれぞれ0.01~0.05L、0.02~0.07L、−0.54~−0.39mL/min/mmHg及び−0.29~−0.23mL/min/mmHg/Lで推移した。
略語一覧
- FVC:努力肺活量
- FEV1:1秒量
- TLC:全肺気量
- DLCO:一酸化炭素拡散能
- VA:肺胞換気量
2025年11月作成
17050-14/N6 60 GMJ