- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(間質性肺疾患に伴う肺高血圧症):海外第Ⅱ/Ⅲ相継続試験 安全性
 Clinical Study海外第Ⅱ/Ⅲ相継続試験(間質性肺疾患に伴う肺高血圧症)
Clinical Study海外第Ⅱ/Ⅲ相継続試験(間質性肺疾患に伴う肺高血圧症)
安全性
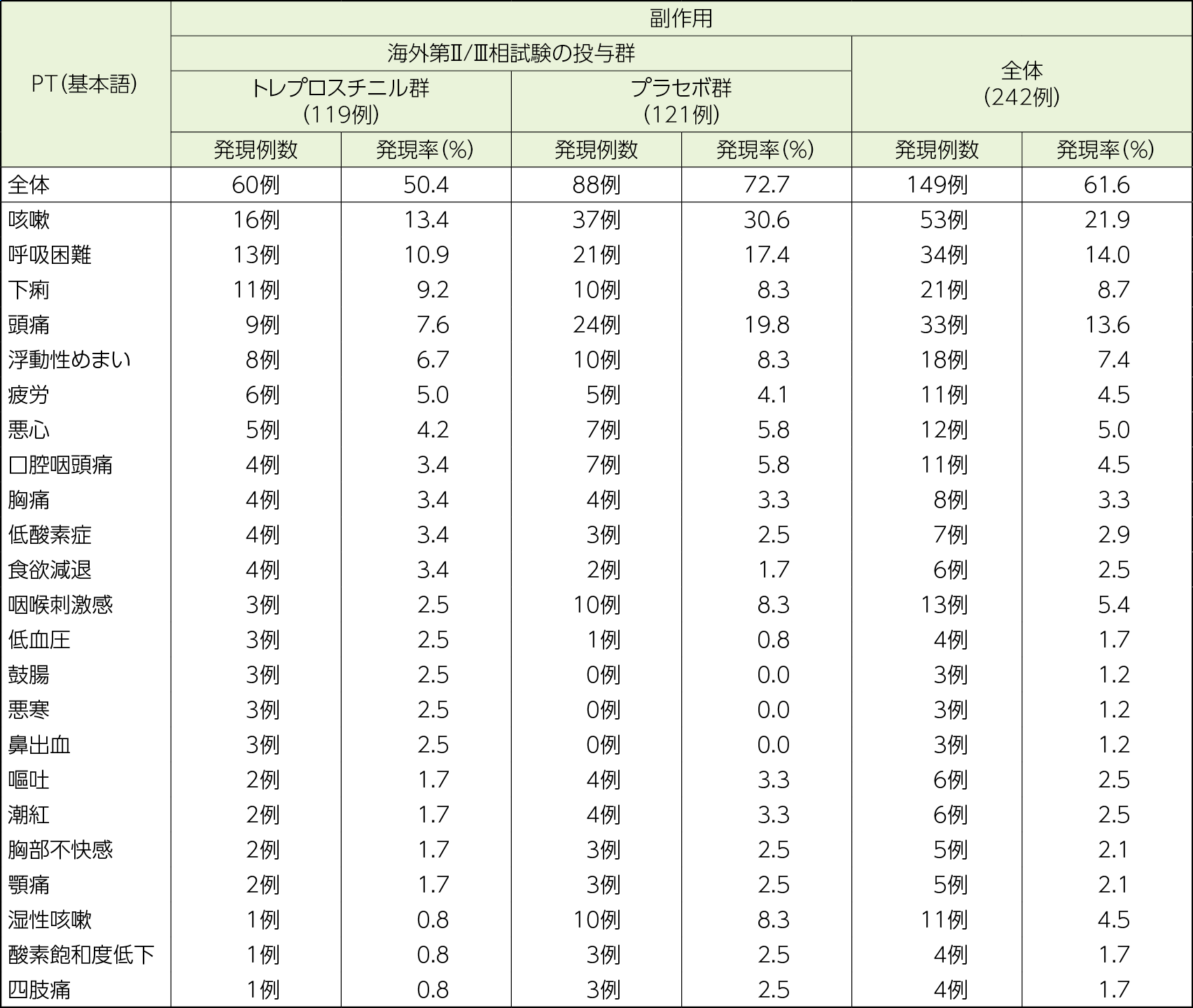
副作用
副作用の発現率は、海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団及び海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で、それぞれ50.4%(60/119例)及び72.7%(88/121例)であった。
発現率が10%以上の副作用は、海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で咳嗽16例(13.4%)、呼吸困難13例(10.9%)、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で咳嗽37例(30.6%)、頭痛24例(19.8%)、呼吸困難21例(17.4%)であった。
重篤な副作用は海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で11例、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で16例であり、主な重篤な副作用は海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で急性呼吸不全、呼吸困難(各2例)、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で急性呼吸不全、血液量増加症(各2例)であった。
投与中止に至った副作用は海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で5例、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で14例であり、主な投与中止に至った副作用は海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で呼吸困難(2例)、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で呼吸困難、低酸素症(各3例)、咳嗽、疲労(各2例)であった。
死亡に至った副作用は海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で0例、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で3例(4件)であり、内訳は死亡※、急性呼吸不全、うっ血性心不全、間質性肺疾患(各1件)であった。
- ※PTを死亡として集計されたが死因は不明
- 用語辞書:MedDRA/J Ver.26.0
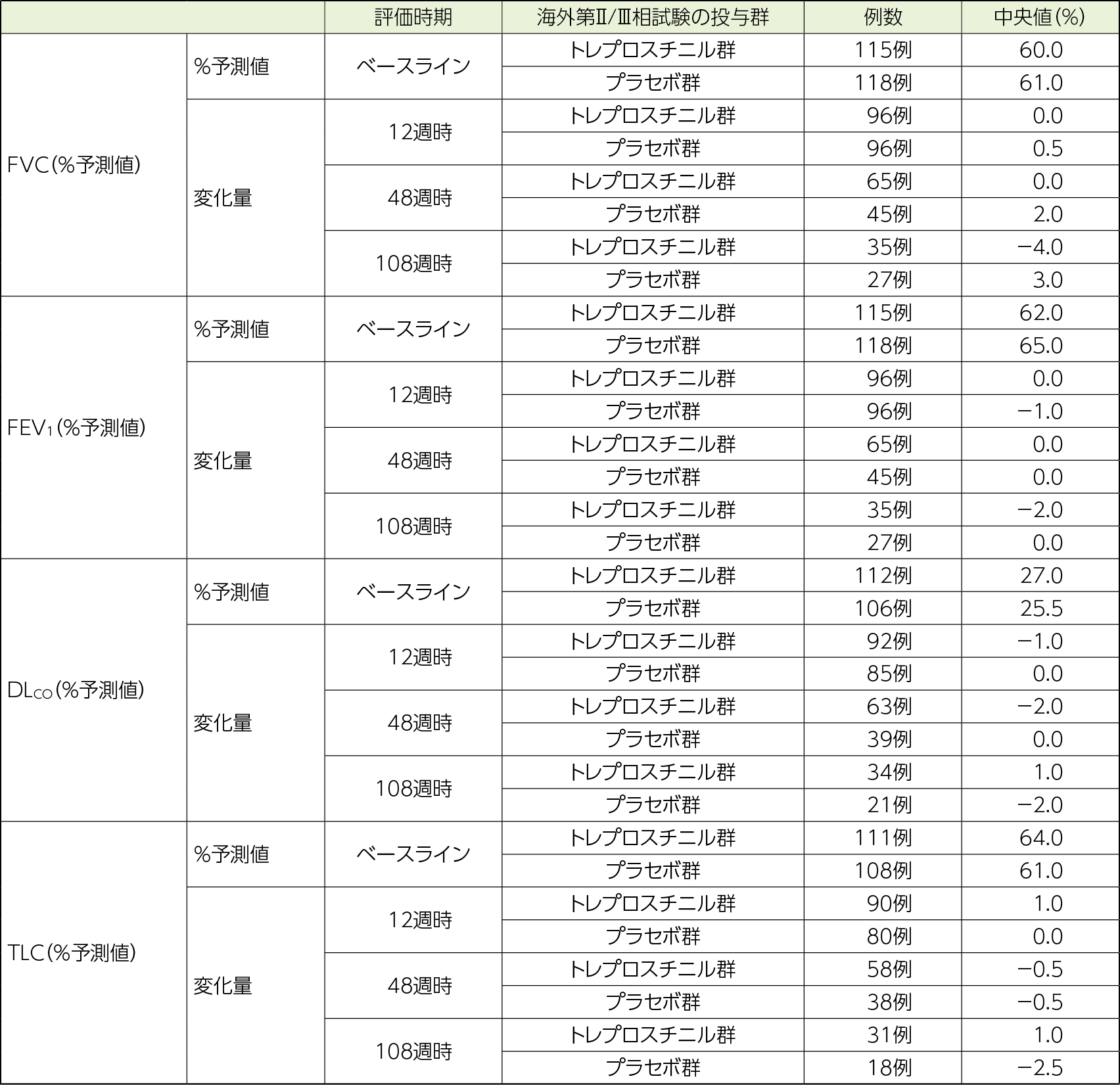
呼吸機能検査
FVC(%予測値)について、12週時、48週時及び108週時におけるベースラインからの変化量(中央値)は、海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団で0.0%、0.0%及び−4.0%、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団で0.5%、2.0%及び3.0%であった。
その他の呼吸機能検査パラメータについて、12週時、48週時、108週時における海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団及び海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団(以下同順)の変化量(中央値)は、FEV1(%予測値)で0.0%、0.0%、−2.0%及び−1.0%、0.0%、0.0%、DLCO(%予測値)で−1.0%、−2.0%、1.0%及び0.0%、0.0%、−2.0%、TLC(%予測値)で1.0%、−0.5%、1.0%及び0.0%、−0.5%、−2.5%であった。
6. 用法及び用量(抜粋)
〈間質性肺疾患に伴う肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、3日以上の間隔で、1回1吸入ずつ、最大12吸入(トレプロスチニルとして72μg)まで漸増する。忍容性がない場合は減量し、1回最小量は1吸入とすること。
2025年11月作成
17050-14/N6 60 GMJ