- 医療関係者向けホーム
- 消化器領域
- リアルダ®錠
- Clinical Study:成人(各臨床試験での定義:16歳以上)の潰瘍性大腸炎患者に対する臨床成績:寛解期 安全性
 Clinical Study
Clinical Study
成人(各臨床試験での定義:16歳以上)の潰瘍性大腸炎患者に対する臨床成績:寛解期
安全性
投与期の有害事象の発現率は、リアルダ2400mg/日(1日1回)群では82.0%(82/100例)、時間依存型メサラジン放出調節製剤2250mg/日(1日3回)群では85.4%(88/103例)であった。
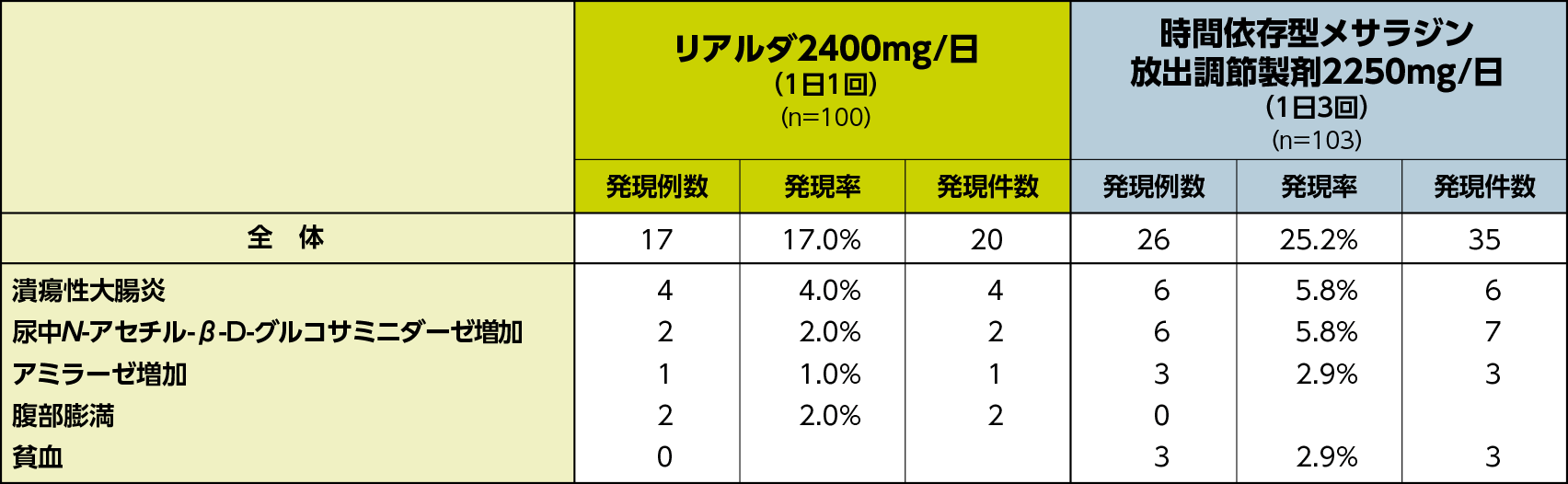
投与期の副作用の発現率は、リアルダ2400mg/日(1日1回)群では17.0%(17/100例)、時間依存型メサラジン放出調節製剤2250mg/日(1日3回)群では25.2%(26/103例)であり、主なもの(いずれかの群で発現率2%以上)は、潰瘍性大腸炎〔各群4.0%(4例)、5.8%(6例)〕、尿中N-アセチル-β-D-グルコサミニダーゼ増加〔各群2.0%(2例)、5.8%(6例)〕、腹部膨満〔各群2.0%(2例)、0例〕、アミラーゼ増加〔各群1.0%(1例)、2.9%(3例)〕、貧血〔各群0例、2.9%(3例)〕であった。
投与期の中止に至った副作用の発現率は、リアルダ2400mg/日(1日1回)群では8.0%(8/100例)であり、潰瘍性大腸炎が4例、頭痛、腹部膨満、そう痒症、全身性そう痒症および四肢痛は1例ずつ、時間依存型メサラジン放出調節製剤2250mg/日(1日3回)群では5.8%(6/103例)であり、潰瘍性大腸炎が4例、肝機能異常およびアミラーゼ増加は1例ずつであった。
本試験において、重篤な副作用および死亡例は認められなかった。
2025年12月作成
14407-18/N14 B8 MDC