- 医療関係者向けホーム
- 消化器領域
- リアルダ®錠
- Clinical Study:成人(各臨床試験での定義:16歳以上)の潰瘍性大腸炎患者に対する臨床成績:寛解期 血便の非発現率
 Clinical Study
Clinical Study
成人(各臨床試験での定義:16歳以上)の潰瘍性大腸炎患者に対する臨床成績:寛解期
血便の非発現率
主要評価項目
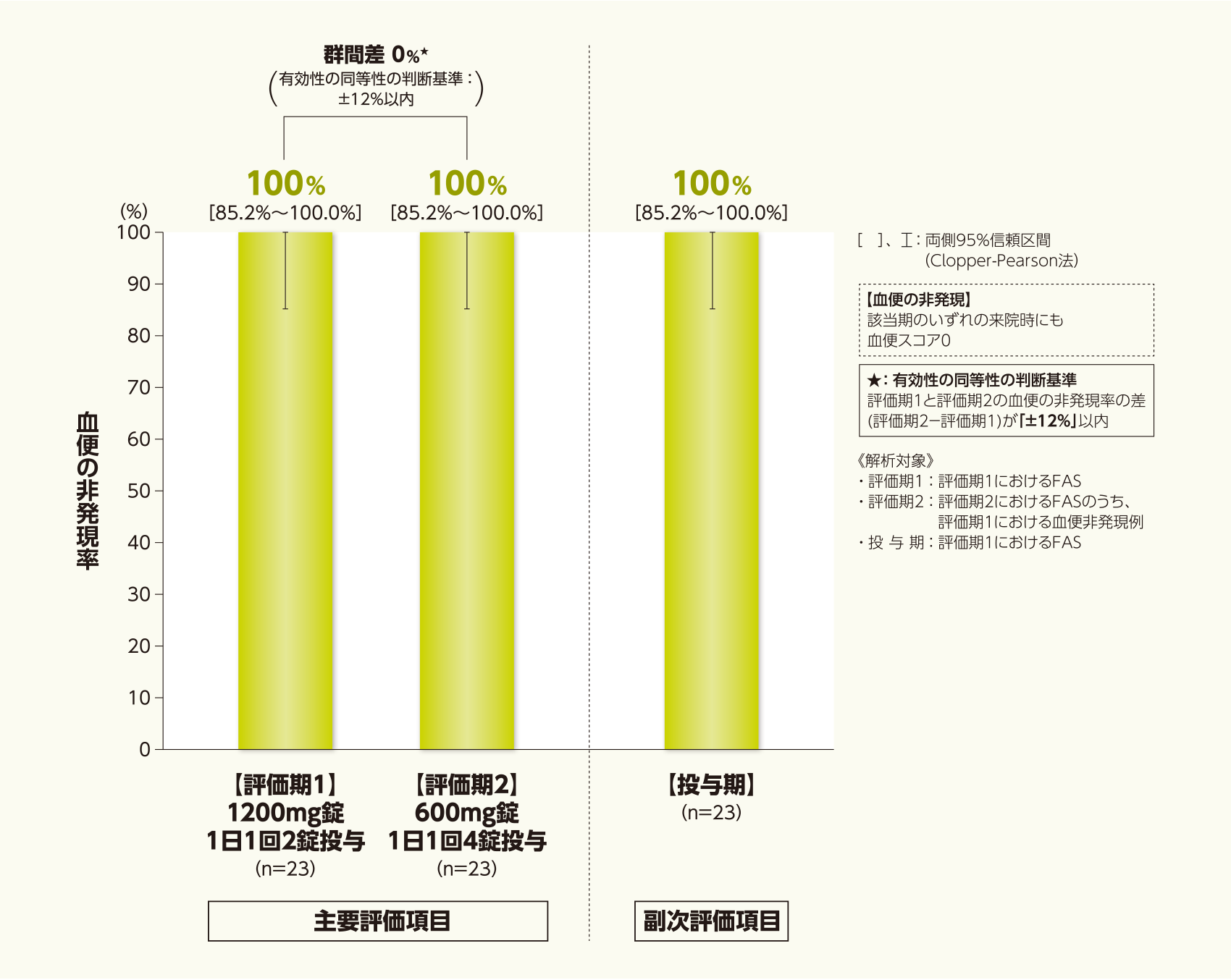
血便の非発現率[評価期1、評価期2]
寛解期の16歳以上の潰瘍性大腸炎患者において、血便の非発現率を評価期1(1200mg錠 1日1回2錠投与)および評価期2(600mg錠 1日1回4錠投与)で比較したところ、評価期1および評価期2のいずれも100%であり、評価期1と評価期2の血便の非発現率の差(評価期2-評価期1)は0%であった。
治験実施計画書で規定した有効性の同等性の判断基準(血便の非発現率の差が±12%以内)を満たしたことから、1200mg錠を1日1回2錠投与した時の有効性と、600mg錠を1日1回4錠投与した時の有効性は同等であると判断した(検証的ではない解析。ただし、承認の根拠となった有効性の成績である)。
副次評価項目
血便の非発現率[投与期]
寛解期の16歳以上の潰瘍性大腸炎患者において、投与期の血便の非発現率は100%であった。
- 7. 用法及び用量に関連する注意
- (抜粋)
- 7.4 使用製剤(本剤1200mg錠及び600mg錠)を切替える場合は、患者の状態を慎重に観察すること。[17.1.3 参照]
2025年12月作成
14407-18/N14 B8 MDC