- 医療関係者向けホーム
- 消化器領域
- リアルダ®錠
- Clinical Study:成人(各臨床試験での定義:16歳以上)の潰瘍性大腸炎患者に対する臨床成績:寛解期 安全性
 Clinical Study
Clinical Study
成人(各臨床試験での定義:16歳以上)の潰瘍性大腸炎患者に対する臨床成績:寛解期
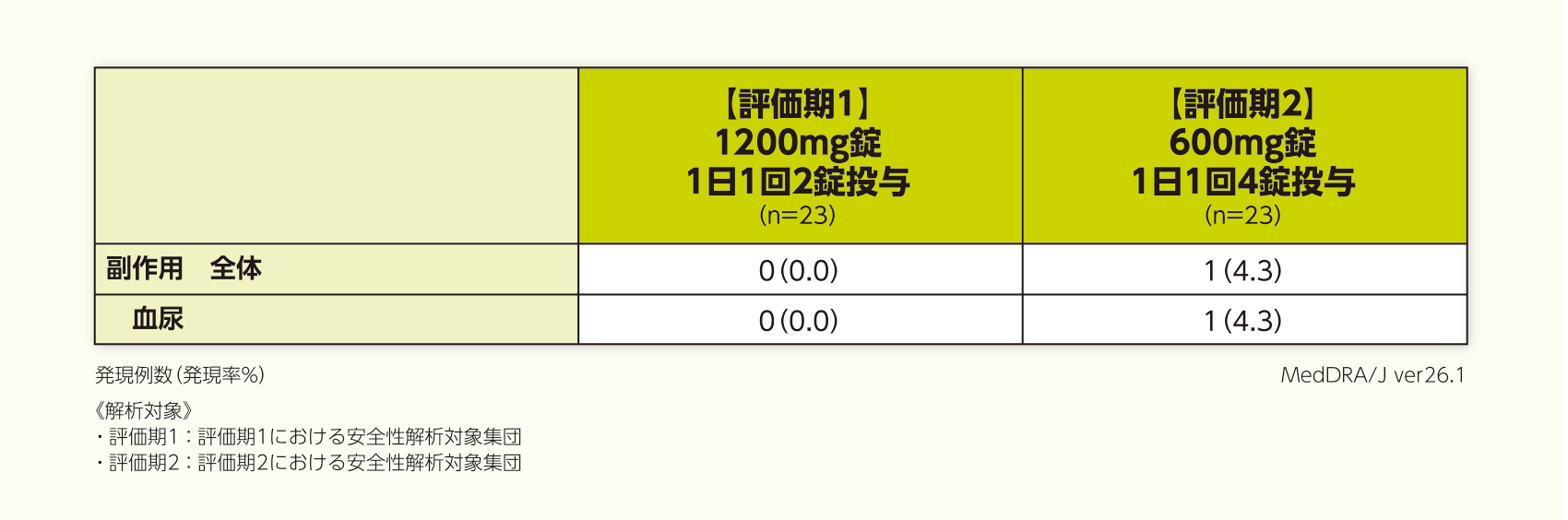
安全性
有害事象の発現率は、評価期1(1200mg錠 1日1回2錠投与)では30.4%(7/23例)、評価期2(600mg錠 1日1回4錠投与)では43.5%(10/23例)であり、主なもの(いずれかの評価期で発現例数2例以上)はCOVID-19〔評価期1:4.3%(1/23例)、評価期2:13.0%(3/23例)〕および大腸ポリープ〔評価期1:0%(0/23例)、評価期2:8.7%(2/23例)〕であった。
なお、副作用の発現率は、評価期1では0%(0/23例)、評価期2では4.3%(1/23例:血尿1例)であった。
本試験において、重篤な有害事象、投与中止に至った有害事象、死亡に至った有害事象は両評価期で認められなかった。
- 7. 用法及び用量に関連する注意
- (抜粋)
- 7.4 使用製剤(本剤1200mg錠及び600mg錠)を切替える場合は、患者の状態を慎重に観察すること。[17.1.3 参照]
2025年12月作成
14407-18/N14 B8 MDC