- 医療関係者向けホーム
- ディナゲスト錠0.5mg
- Clinical Study:国内第Ⅱ相用量探索試験(12週間投与) 安全性
 Clinical Study国内第Ⅱ相用量探索試験(12週間投与)
Clinical Study国内第Ⅱ相用量探索試験(12週間投与)
安全性
有害事象発現率〔主要評価項目〕
有害事象の発現率は、プラセボ群56.5%(26/46例)、0.25mg×2/日群97.8%(45/46例)、0.5mg×2/日群95.7%(45/47例)、1mg×2/日群95.9%(47/49例)であった。なお、参照薬群の有害事象の発現率は83.0%(39/47例)であった。死亡に至った有害事象及び重篤な有害事象は認められなかった。
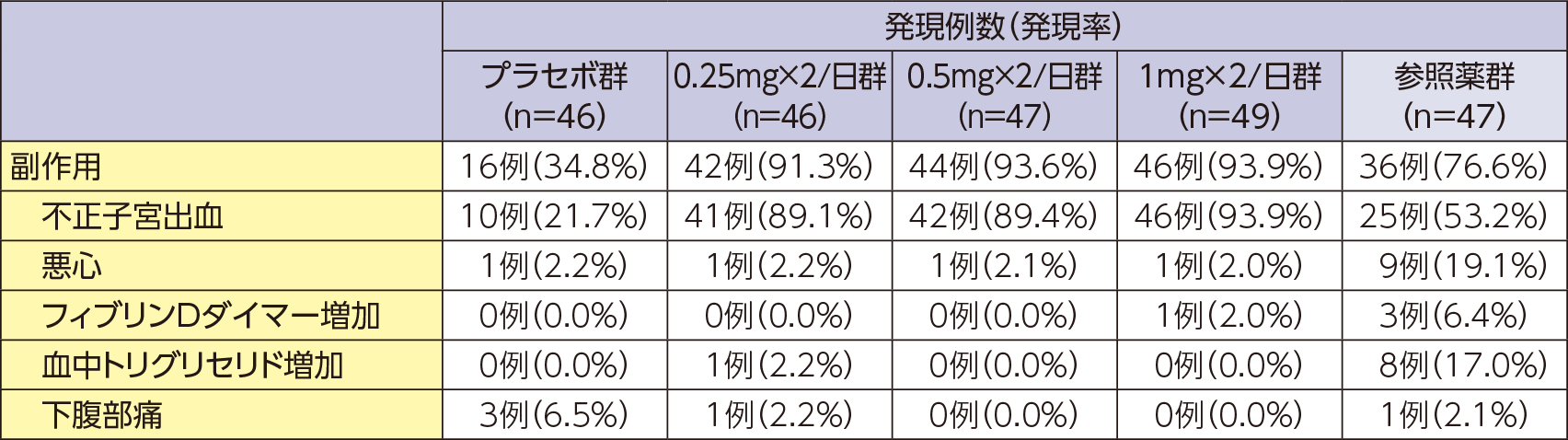
副作用発現率〔副次評価項目〕
副作用の発現率は、プラセボ群34.8%(16/46例)、0.25mg×2/日群91.3%(42/46例)、0.5mg×2/日群93.6%(44/47例)、1mg×2/日群93.9%(46/49例)であった。なお、参照薬群の副作用の発現率は76.6%(36/47例)であった。本試験の0.25mg×2/日群、0.5mg×2/日群、1mg×2/日群、参照薬群において、死亡に至った副作用及び重篤な副作用は認められず、投与中止に至った副作用は0.25mg×2/日群4例(頭痛、悪心、下腹部痛、不正子宮出血、末梢性浮腫が各1件)、0.5mg×2/日群3例(抑うつ症状、頭痛、悪心、接触皮膚炎、筋骨格硬直、不正子宮出血が各1件)、1mg×2/日群2例(易刺激性、気力低下、肝機能検査異常が各1件)、参照薬群2例(閉経期症状、凝固検査異常が各1件)に認められた。