- 医療関係者向けホーム
- ディナゲスト錠0.5mg
- Clinical Study:国内第Ⅲ相長期投与試験(52週間投与) 安全性
 Clinical Study国内第Ⅲ相長期投与試験(52週間投与)
Clinical Study国内第Ⅲ相長期投与試験(52週間投与)
安全性
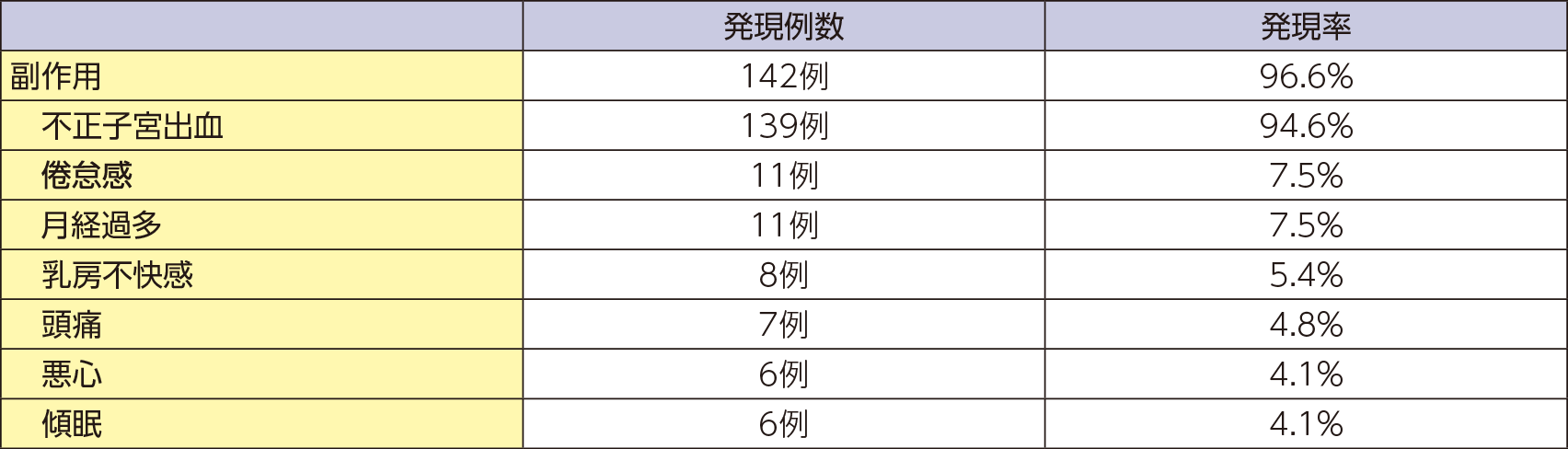
有害事象発現率〔主要評価項目〕
有害事象の発現率は、98.6%(145/147例)であった。主な有害事象は不正子宮出血94.6%(139例)、上咽頭炎40.1%(59例)、インフルエンザ、倦怠感、月経過多が各7.5%(各11例)等であった。死亡に至った有害事象は認められなかった。重篤な有害事象は3例に認められ、急性腎盂腎炎、視神経炎及び腸炎であった。