- 医療関係者向けホーム
- 産婦人科領域
- ディナゲスト
- ディナゲスト錠・OD錠1mg
- Clinical Study:国内第Ⅲ相長期投与試験〈52週間投与〉(子宮腺筋症) 安全性
 Clinical Study国内第Ⅲ相長期投与試験〈52週間投与〉(子宮腺筋症)
Clinical Study国内第Ⅲ相長期投与試験〈52週間投与〉(子宮腺筋症)
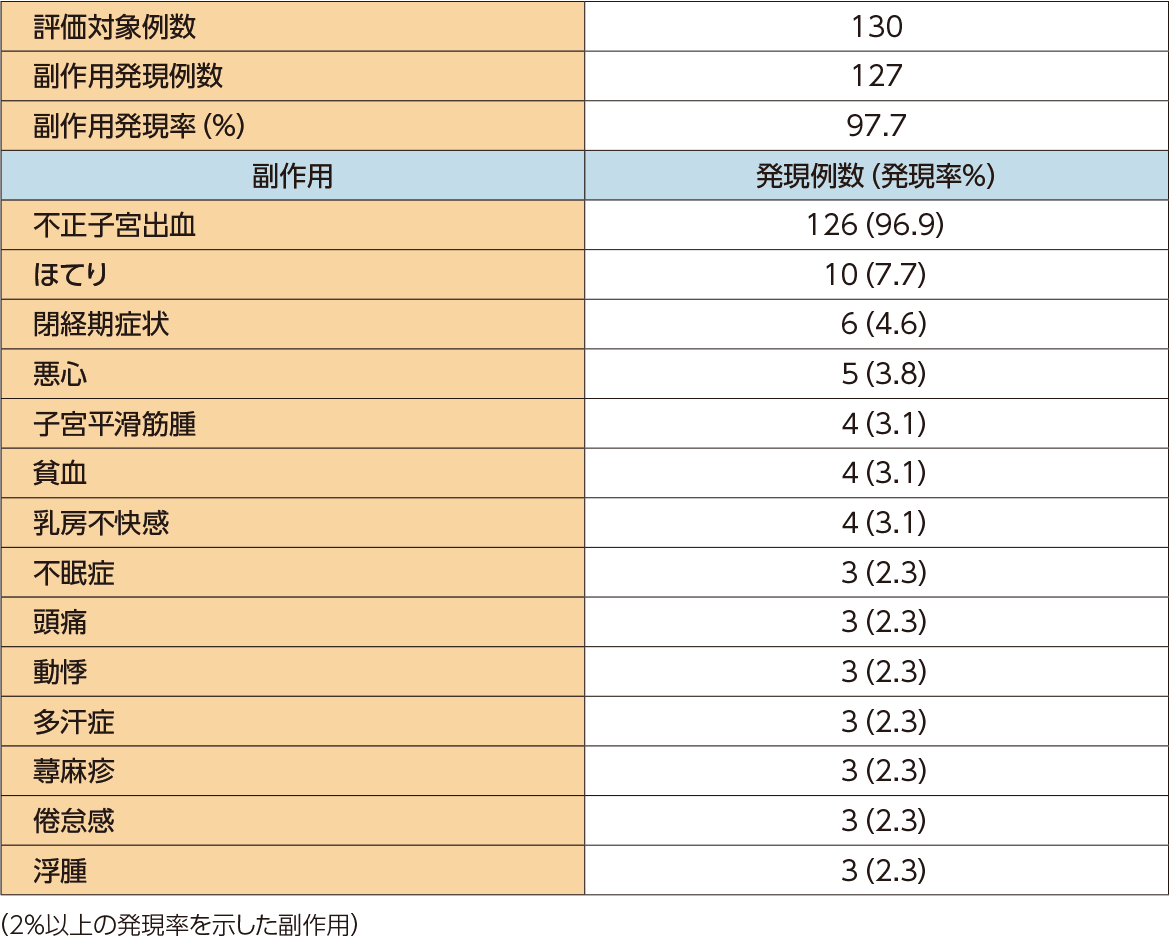
安全性
主要評価項目
有害事象発現率
有害事象の発現率は、99.2%(129/130例)であった。主な有害事象は不正子宮出血(96.9%)、鼻咽頭炎(46.2%)、ほてり(8.5%)などであった。