- 医療関係者向けホーム
- 循環器領域
- エパデールS/カプセル
- Clinical Study:JELIS 安全性
 Clinical StudyJELIS
Clinical StudyJELIS
安全性
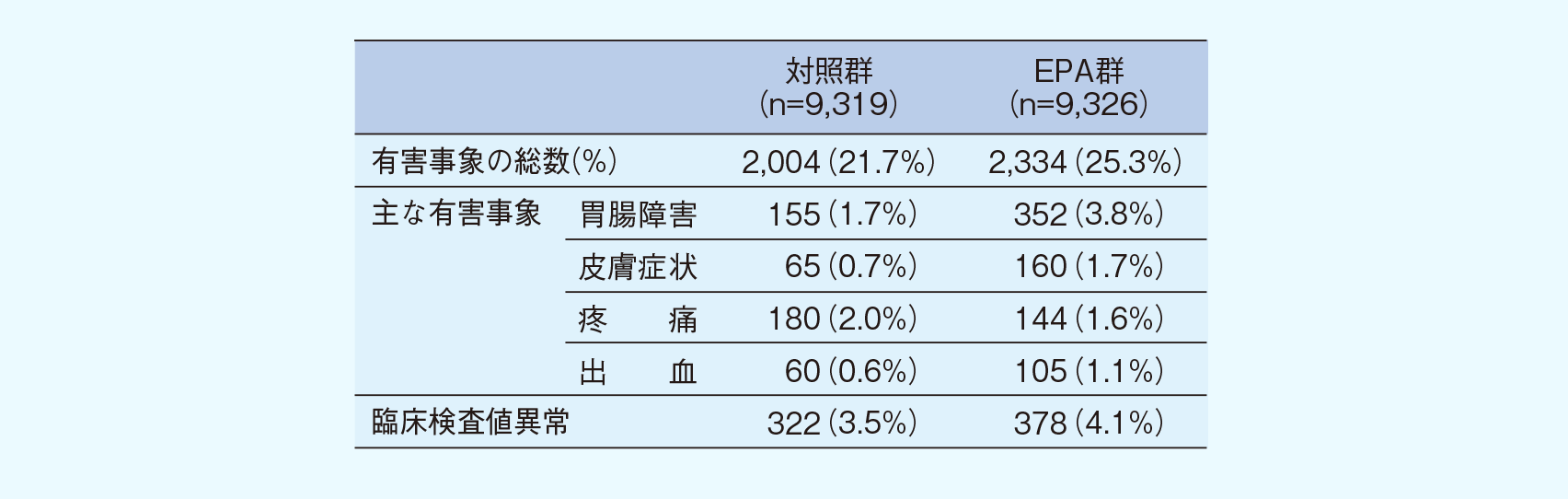
安全性(安全性評価項目)
本論文には、投与中止に至った有害事象の内訳や、死亡例を含む重篤な有害事象に関する記載はなかった(安全性の詳細は電子添文をご参照ください)。
- Yokoyama M. et al. LANCET 2007 ; 369(9567) : 1090-1098
- [利益相反]本研究は持田製薬株式会社の支援(研究費用、学会発表の筆頭発表者旅費など)により実施された。
安全性(再審査申請資料)
JELIS試験 有害事象集計検討の概要
- 対象:日本人高脂血症患者の登録症例18,661例のうち、登録後観察なしの206例を除外した18,455例
- 方法:担当医師より報告があった全有害事象を集計し、両群間(対照群、EPA群)の発現例数の比較を行った。
有害事象は、年次調査票のイベント発症欄及び有害事象欄、イベント報告書「心血管」、イベント報告書「その他」、重篤有害事象報告書に記載された事象とした。
全有害事象に MedDRA(Ver.4.1)でコードを付し、器官別大分類(以下SOC)及び下層語(以下LLT)でグループ化を行った後、集計しオッズ比を求めた。その際、95%信頼区間を求めた。
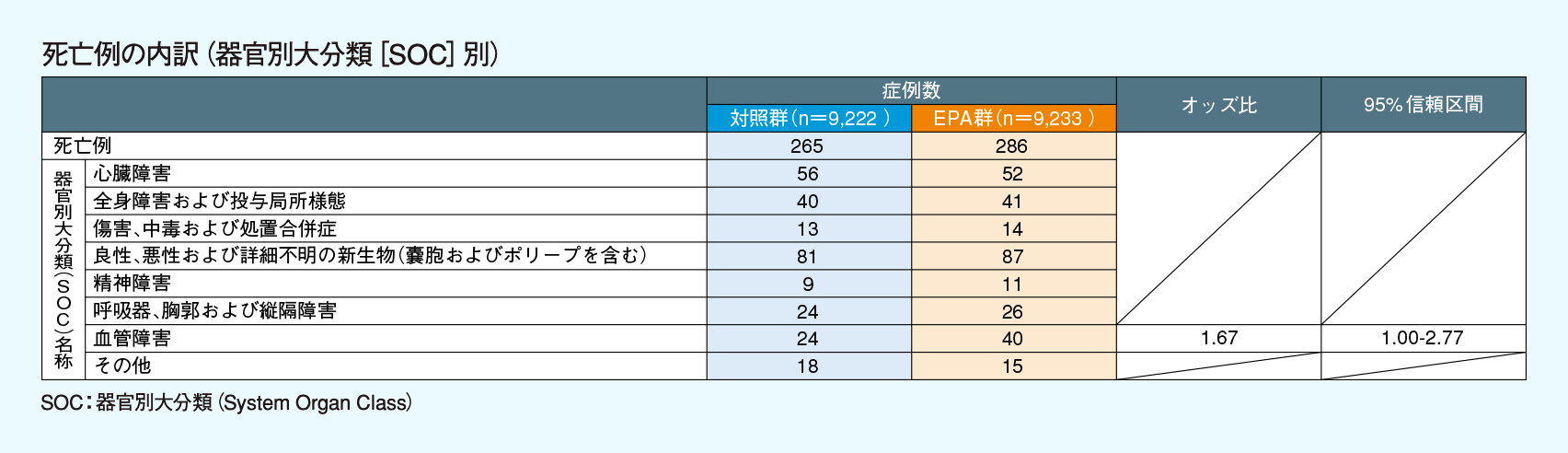
エパデールカプセル及びエパデールSの再審査申請時にJELIS試験の安全性が解析されており、JELIS試験の論文中には記載のなかった死亡例に関する結果は以下の通りであった。なお、重篤な副作用(又は有害事象)の集計・比較は行われていない。
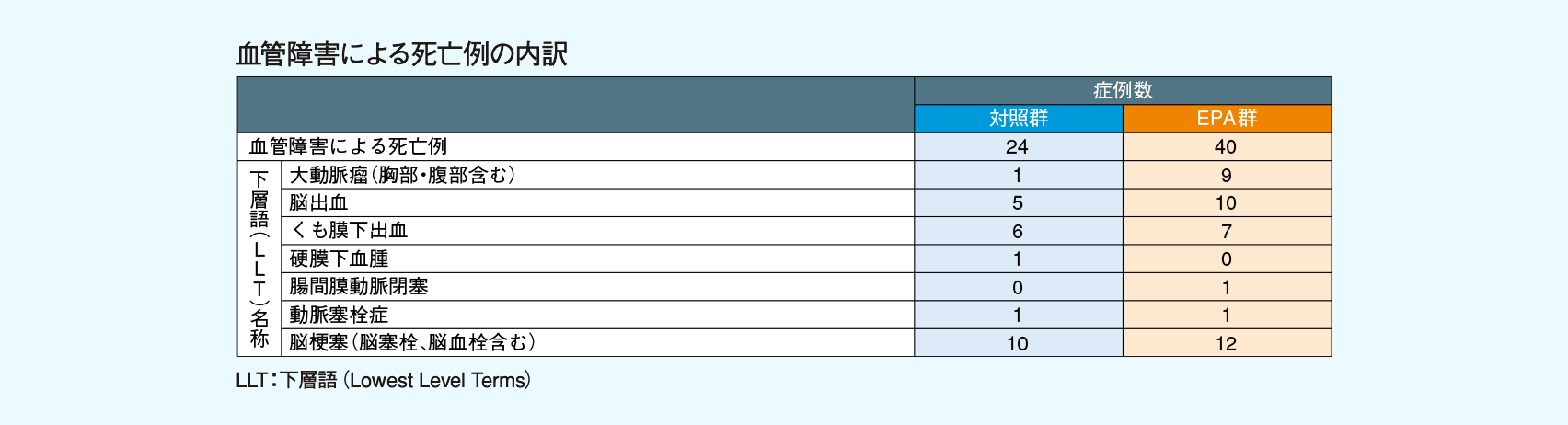
死亡例は対照群265例、EPA群286例であった。死亡例の内訳(器官別大分類[SOC]別)及び血管障害による死亡例の内訳(下層語[LLT]別)は、下表の通りであった。
- エパデールカプセル300、エパデールS300、同600、同900 再審査申請資料