- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Clinical Study:第Ⅱ相及び第Ⅲ相二重盲検試験の併合解析による患者背景別血清尿酸値低下作用(部分集団解析) 投与前肝機能検査値異常の有無別成績
 Clinical Study第Ⅱ相及び第Ⅲ相二重盲検試験の併合解析による患者背景別血清尿酸値低下作用(部分集団解析)
Clinical Study第Ⅱ相及び第Ⅲ相二重盲検試験の併合解析による患者背景別血清尿酸値低下作用(部分集団解析)
投与前肝機能検査値異常の有無別成績
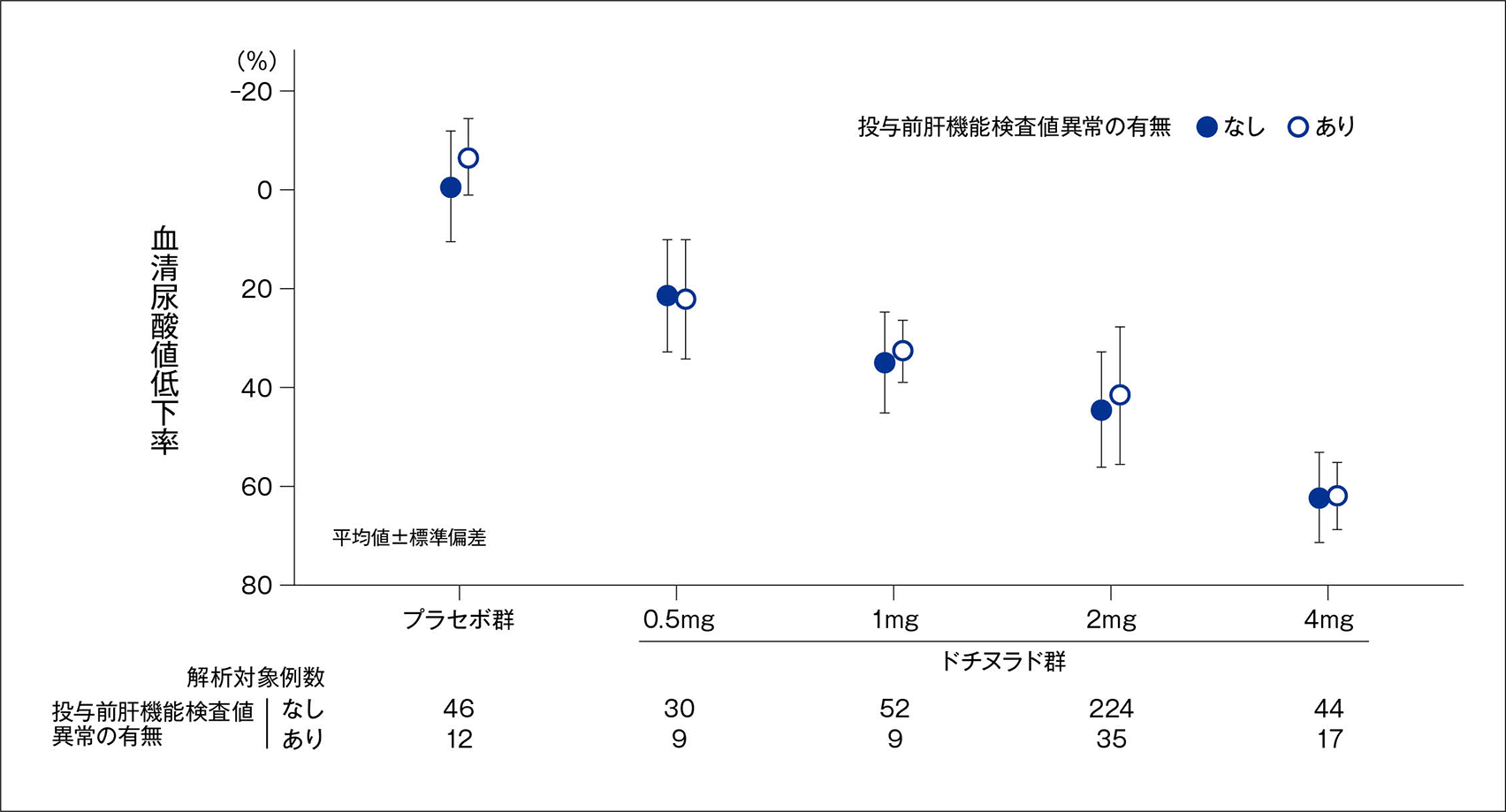
[投与前肝機能検査値異常の有無別]投与終了時の血清尿酸値低下率
(FAS解析対象、部分集団解析、LOCF)
ドチヌラドによる投与前肝機能検査値異常の有無別の血清尿酸値低下率(平均値±標準偏差)は、下図のとおりで、プラセボ群では異常なしで-0.41±11.10%、異常ありで-6.30±7.70%であり、それぞれ0.5mg群では21.65±11.36%、22.32±12.00%、1mg群では35.20±10.04%、32.74±6.42%、2mg群では44.62±11.77%、41.70±13.88%、4mg群では62.30±9.17%、61.99±6.57%であった。
8. 重要な基本的注意(一部抜粋)
- 8.3 他の尿酸排泄促進薬において重篤な肝障害が報告されていることから、本剤投与中は、定期的に肝機能検査を行うなど、患者の状態を十分に観察すること。[9.3参照]
9. 特定の背景を有する患者に関する注意(一部抜粋)
9.3 肝機能障害患者
慎重な経過観察を行うこと。他の尿酸排泄促進薬では重篤な肝障害が認められている。
なお、臨床試験では、重篤な肝疾患を有する患者、AST又はALT 100IU/L以上の患者は除外されている。[8.3参照]