- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Clinical Study(潰瘍性大腸炎)「維持期」に対する効果 日本人部分集団(サブグループ解析)
 Clinical Study(潰瘍性大腸炎)「維持期」に対する効果
Clinical Study(潰瘍性大腸炎)「維持期」に対する効果
日本人部分集団(サブグループ解析)
有効性
●40週時点で臨床的寛解を達成した患者の割合
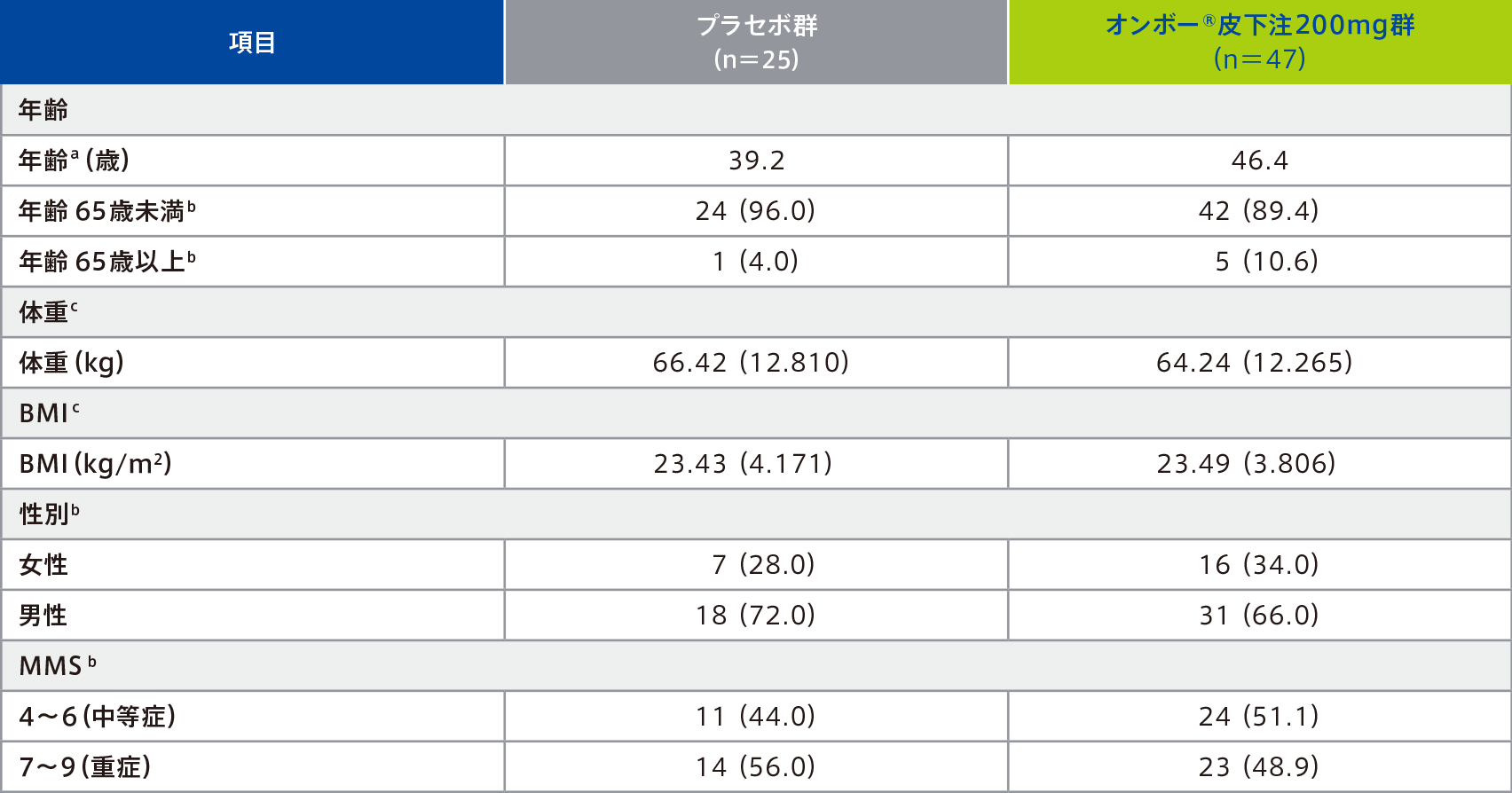
(主要評価項目のサブグループ解析:日本人部分集団)
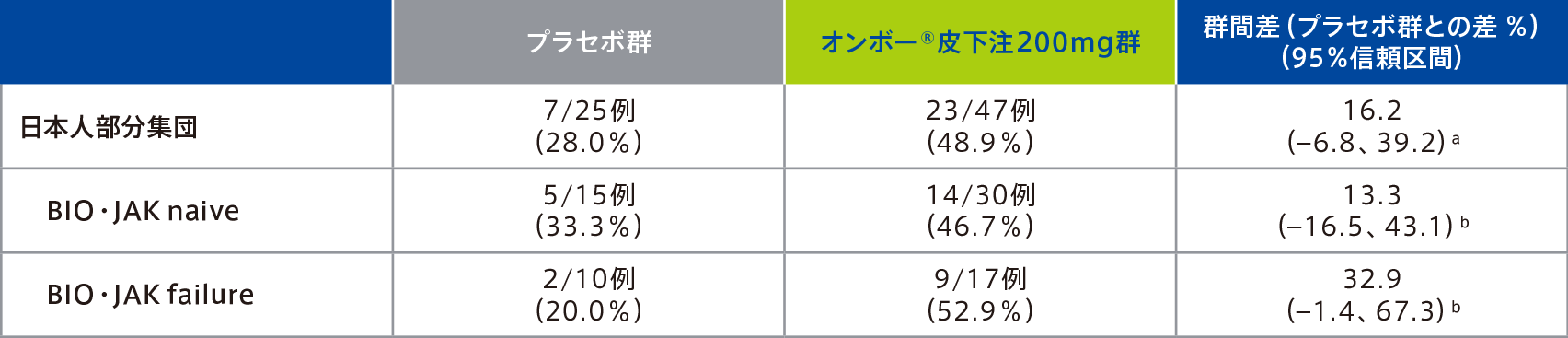
(日本人部分集団のサブグループ解析:BIO・JAK naive/BIO・JAK failure)
日本人部分集団における40週時点で臨床的寛解を達成した患者の割合は、オンボー®皮下注200mg群48.9%(23/47例)、プラセボ群28.0%(7/25例)であった。
日本人部分集団のBIO・JAK naiveでは、40週時点で臨床的寛解を達成した患者の割合は、オンボー®皮下注200mg群46.7%(14/30例)、プラセボ群33.3%(5/15例)、BIO・JAK failureでは、40週時点で臨床的寛解を達成した患者の割合は、オンボー®皮下注200mg群52.9%(9/17例)、プラセボ群20.0%(2/10例)であった。
mITT、NRI
- a 生物学的製剤に対する治療反応性不良の状況(あり/なし)、LUCENT-1試験のベースラインのステロイド系薬剤の使用(あり/なし)、寛解導入投与による臨床的寛解の状況(あり/なし)を調整因子としたCMH法
- b 正規近似法(連続修正なし)
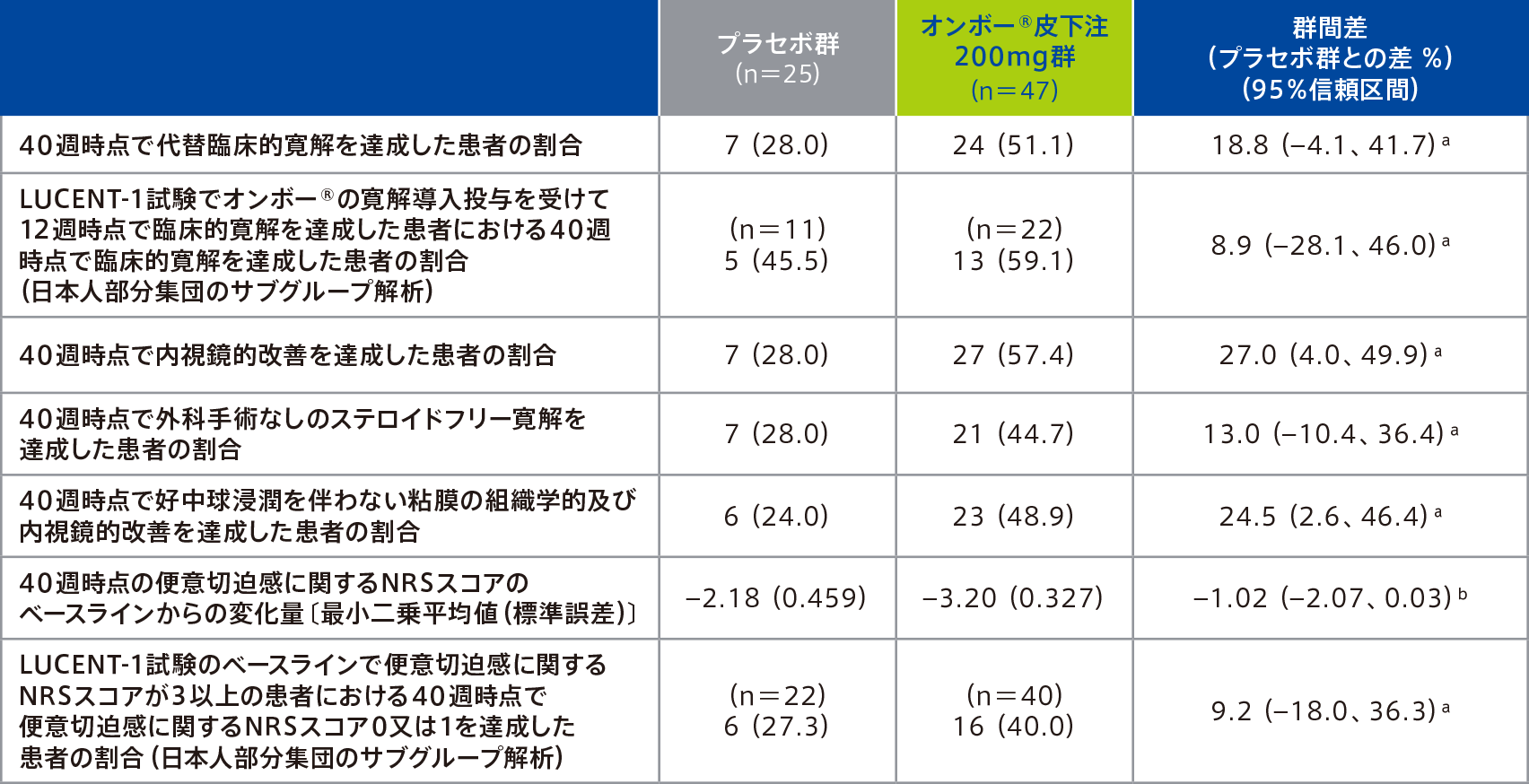
●重要な副次評価項目のサブグループ解析:日本人部分集団
日本人部分集団における重要な副次評価項目の結果は下表のとおりであった。
例数(%)、mITT、NRI(40週時点の便意切迫感に関するNRSスコアのLUCENT-1試験のベースラインからの変化量以外)
- a 生物学的製剤に対する治療反応性不良の状況(あり/なし)、LUCENT-1試験のベースラインのステロイド系薬剤の使用(あり/なし)、寛解導入投与による臨床的寛解の状況(あり/なし)を調整因子としたCMH法
- b 投与群、ベースライン値、時期、ベースライン値と時期の交互作用、投与群と時期の交互作用、生物学的製剤に対する治療反応性不良の状況(あり/なし)、LUCENT-1試験のベースラインのステロイド系薬剤の使用(あり/なし)、寛解導入投与による臨床的寛解の状況(あり/なし)を説明変数とした繰り返し測定値に関するMMRM
欠測値の補完方法:・単一の時点でのデータ欠損の場合、mBOCF法を用いて補完 ・有害事象で投与を中止した場合、ベースラインの値を用いて補完 ・有害事象以外の理由で投与を中止した場合、得られた最終観測データを用いて補完
評価項目の用語の定義についてはLUCENT-2試験の概要参照
安全性
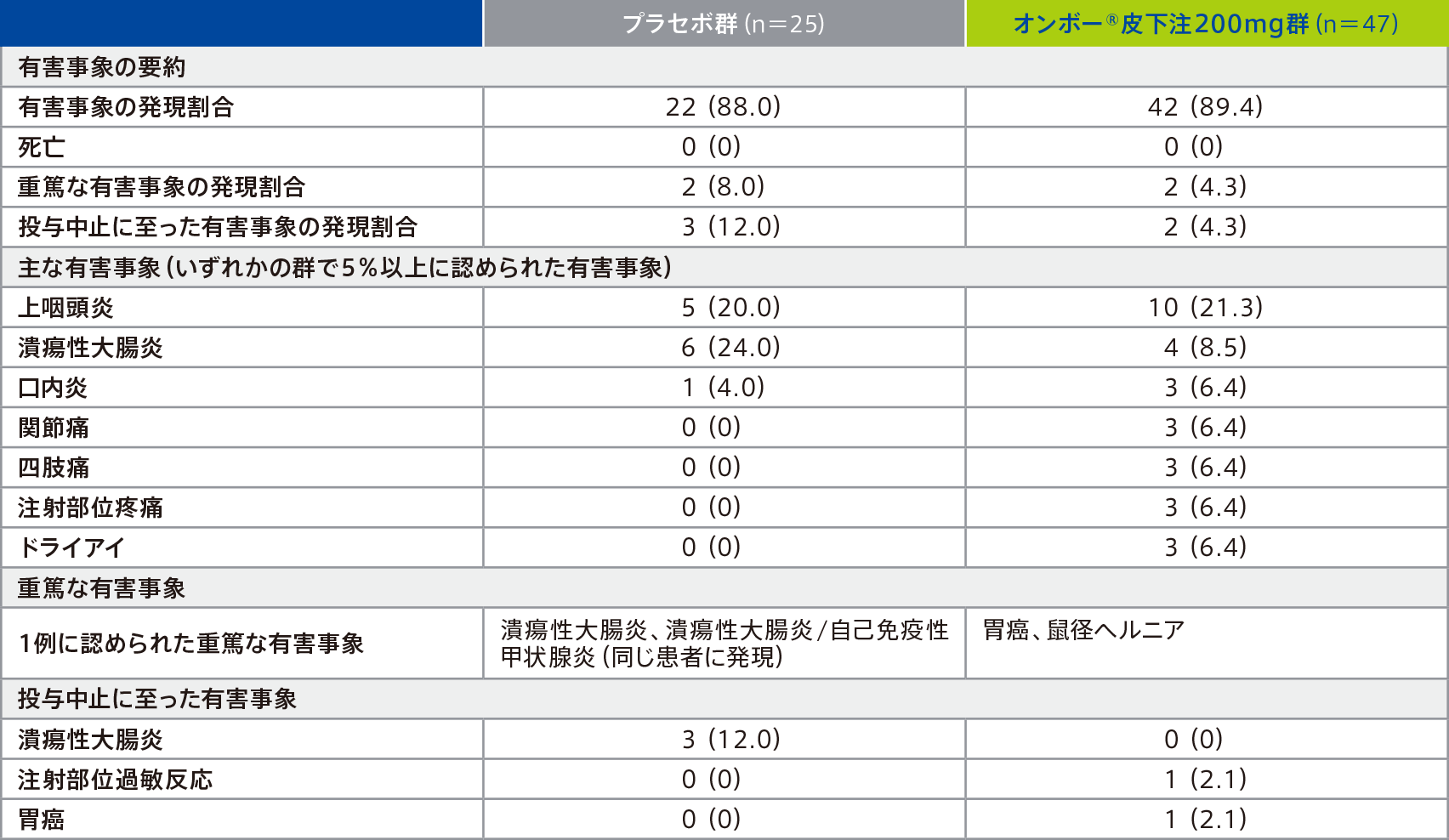
維持期での有害事象は、プラセボ群88.0%(22/25例)、オンボー®皮下注200mg群89.4%(42/47例)に認められ、主な有害事象(いずれかの群で5%以上に認められた有害事象)は下表のとおりであった。
因果関係が否定できない有害事象は、プラセボ群12.0%(3/25例)、オンボー®皮下注200mg群21.3%(10/47例)に認められ、5%以上に認められた因果関係が否定できない有害事象は、オンボー®皮下注200mg群の注射部位疼痛6.4%(3/47例)であった。
本試験において、日本人患者の死亡は認められなかった。
重篤な有害事象は、プラセボ群8.0%〔2/25例、潰瘍性大腸炎、潰瘍性大腸炎/自己免疫性甲状腺炎(同じ患者に発現)各1例〕、オンボー®皮下注200mg群4.3%(2/47例、胃癌、鼠径ヘルニア各1例)に認められた。このうち、プラセボ群の自己免疫性甲状腺炎は、治験薬との因果関係ありと判断された。
投与中止に至った有害事象は、プラセボ群12.0%(3/25例、潰瘍性大腸炎3例)、オンボー®皮下注200mg群4.3%(2/47例、注射部位過敏反応、胃癌各1例)に認められた。
例数(%)(1例に認められた重篤な有害事象以外)
注)LUCENT-1試験において、盲検下でオンボー®寛解導入投与を受けて臨床的改善を達成した患者を対象とした解析セット