- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Clinical Study(潰瘍性大腸炎)「維持期」に対する効果 安全性
 Clinical Study(潰瘍性大腸炎)「維持期」に対する効果
Clinical Study(潰瘍性大腸炎)「維持期」に対する効果
安全性
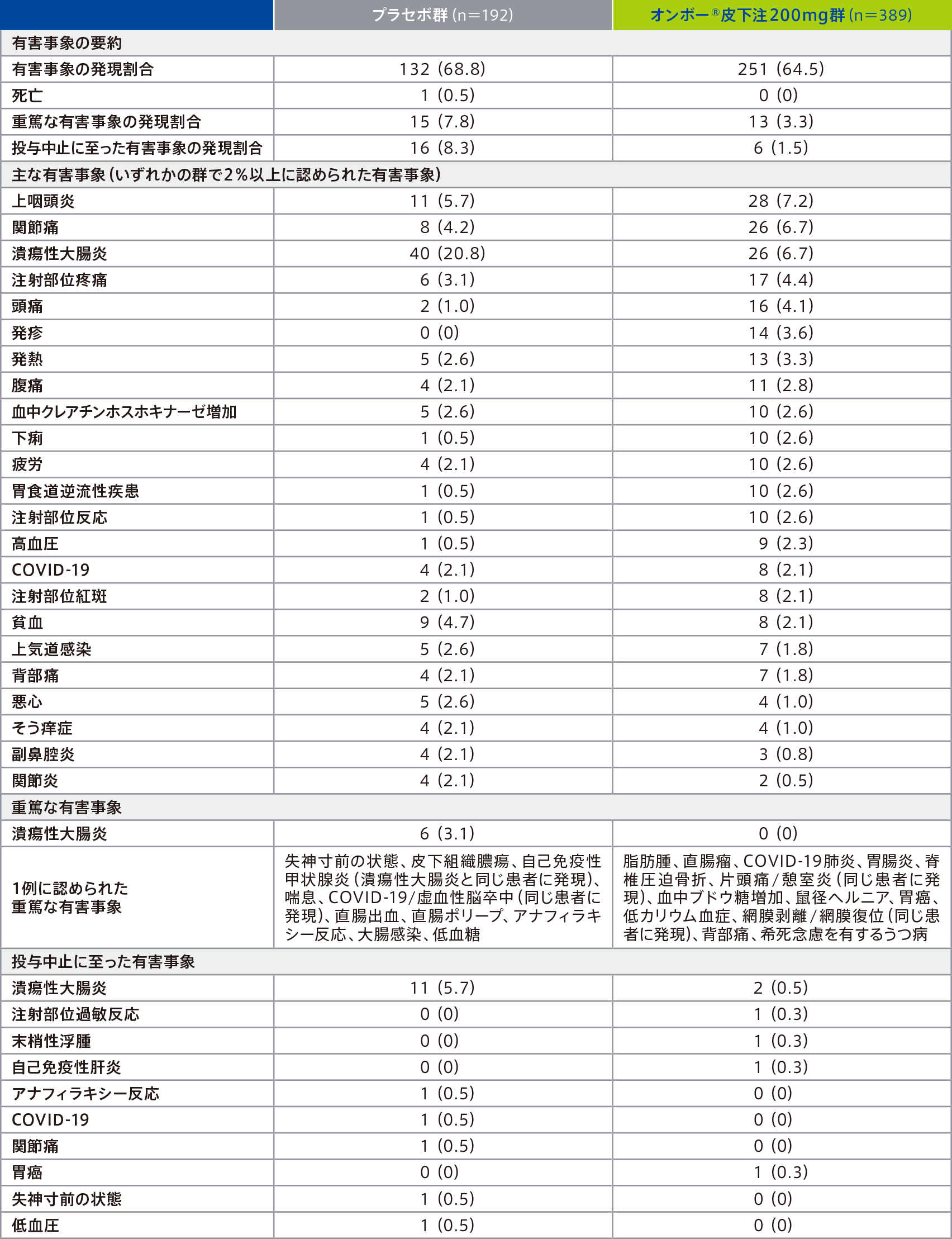
維持期での有害事象は、プラセボ群68.8%(132/192例)、オンボー®皮下注200mg群64.5%(251/389例)に認められ、主な有害事象(いずれかの群で2%以上に認められた有害事象)は下表のとおりであった。
因果関係が否定できない有害事象は、プラセボ群16.7%(32/192例)、オンボー®皮下注200mg群16.7%(65/389例)に認められ、2%以上に認められた因果関係が否定できない有害事象は、プラセボ群では注射部位疼痛3.1%(6/192例)、潰瘍性大腸炎2.6%(5/192例)、オンボー®皮下注200mg群では注射部位疼痛4.1%(16/389例)、注射部位反応2.6%(10/389例)、注射部位紅斑2.1%(8/389例)であった。
プラセボ群1例に死亡(COVID-19)が報告され、治験担当医師により治験薬又は治験手順との因果関係はないと判断された。
重篤な有害事象は、プラセボ群7.8%(15/192例)、オンボー®皮下注200mg群3.3%(13/389例)に認められ、その事象は下表のとおりであった。このうち、プラセボ群の失神寸前の状態、皮下組織膿瘍、自己免疫性甲状腺炎及びアナフィラキシー反応各1例は、治験薬との因果関係ありと判断された。
投与中止に至った有害事象は、プラセボ群8.3%(16/192例)、オンボー®皮下注200mg群1.5%(6/389例)に認められ、その事象は下表のとおりであった。
例数(%)(1例に認められた重篤な有害事象以外)
注)LUCENT-1試験において、盲検下でオンボー®寛解導入投与を受けて臨床的改善を達成した患者を対象とした解析セット