- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ対照二重盲検比較試験(海外データ)(うつ病・うつ状態) 安全性
 Clinical Study第Ⅲ相プラセボ対照二重盲検比較試験(海外データ)(うつ病・うつ状態)
Clinical Study第Ⅲ相プラセボ対照二重盲検比較試験(海外データ)(うつ病・うつ状態)
安全性
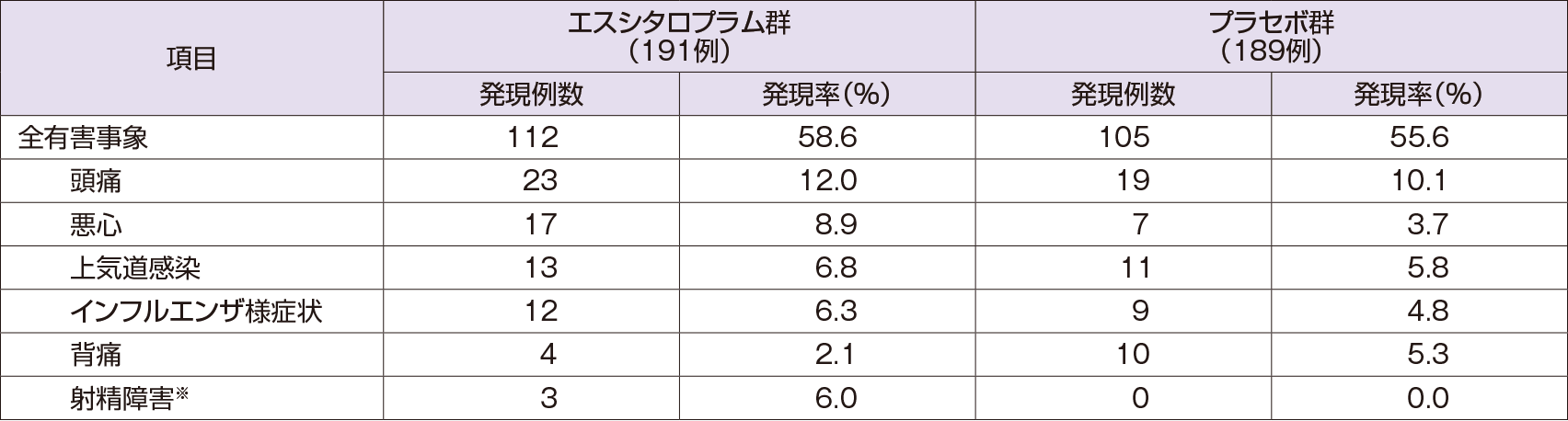
有害事象
全有害事象は、エスシタロプラム群191例中112例(58.6%)、プラセボ群189例中105例(55.6%)に認められた。いずれかの群で5%を超えて発現した有害事象は以下の通りであった。
- ※:男性のみの母数を用いた
投与中止
投与中の中止は、エスシタロプラム群191例中31例(16.2%)、プラセボ群189例中29例(15.3%)であり、そのうち有害事象による中止はそれぞれ9例(4.7%)、2例(1.1%)であった。このうちエスシタロプラム群の3例、プラセボ群の1例の中止理由は悪心であった。