- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態) 安全性
 Clinical Study第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態)
Clinical Study第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態)
安全性
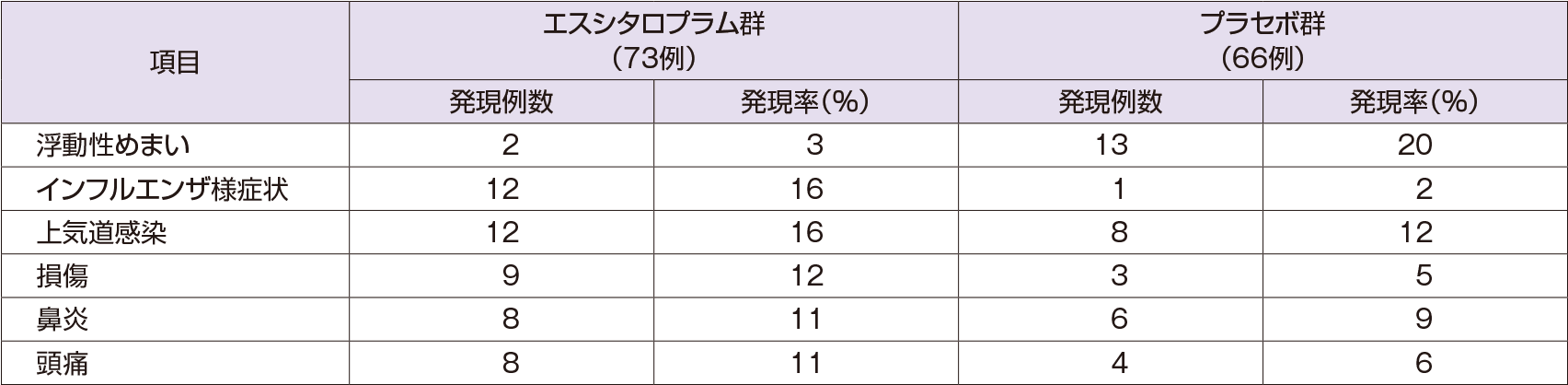
維持治療期に発現した有害事象
維持治療期においていずれかの群で10%以上発現した有害事象は下表の通りであった。維持治療期における重篤な有害事象は、エスシタロプラム群73例中2例(2.7%)に2件(低血圧、膀胱・子宮腟脱)、プラセボ群66例中1例(1.5%)に自殺企図が認められたが、いずれも薬剤との因果関係は認められなかった。
- ※継続治療期における主な有害事象については本論文に記載なし。
投与中止
継続治療期における中止例は、234例中70例(30%)にみられた。そのうち、有害事象による中止は14例(6%)であった。継続治療期の完了例164例のうち25例(15%)が治療継続不適格(継続治療期16週時のMADRS合計点12点以上)により維持治療期のランダム化前に中止した。
維持治療期における中止例は、エスシタロプラム群73例中23例(32%)、プラセボ群66例中30例(45%)であった。そのうち有害事象による中止例は、それぞれ3例(4%)、6例(9%)であった。