- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Clinical Study(クローン病)「クローン病」に対する効果 安全性
 Clinical Study(クローン病)「クローン病」に対する効果
Clinical Study(クローン病)「クローン病」に対する効果
安全性
●全体集団
<第1期(0~12週)>
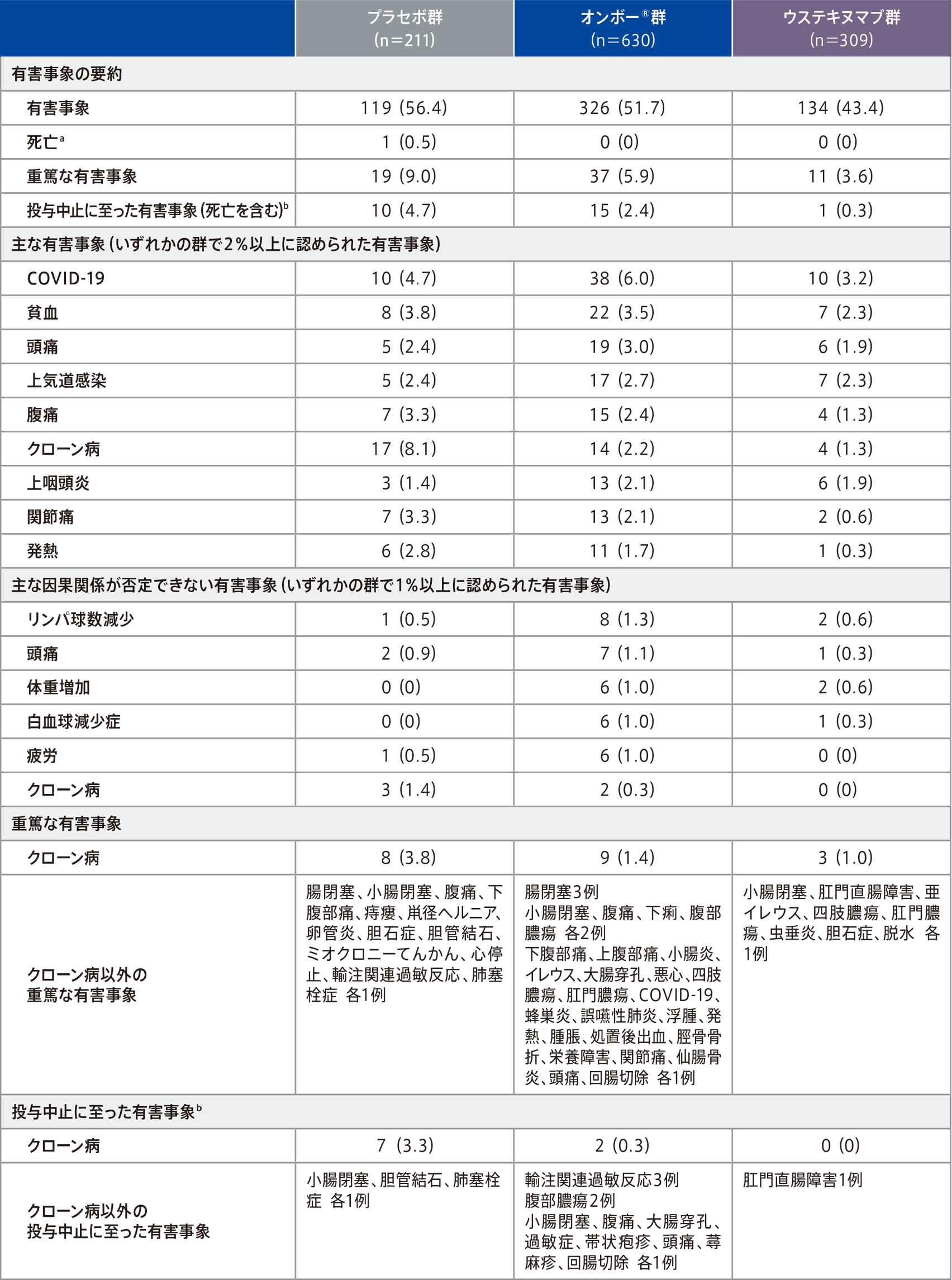
第1期での有害事象は、プラセボ群56.4%(119/211例)、オンボー®群51.7%(326/630例)、ウステキヌマブ群43.4%(134/309例)に認められ、主な有害事象(いずれかの群で2%以上に認められた有害事象)は表のとおりであった。
因果関係が否定できない有害事象は、プラセボ群10.4%(22/211例)、オンボー®群17.6%(111/630例)、ウステキヌマブ群10.0%(31/309例)に認められ、1%以上に認められた因果関係が否定できない有害事象は表のとおりであった。
第1期のプラセボ群1例に死亡(心停止/肺塞栓症)が報告され、治験担当医師により治験薬との因果関係はないと判断された。
重篤な有害事象は、プラセボ群9.0%(19/211例)、オンボー®群5.9%(37/630例)、ウステキヌマブ群3.6%(11/309例)に認められ、その事象は表のとおりであった。このうち、プラセボ群の腸閉塞、痔瘻、輸注関連過敏反応各1例、オンボー®群のクローン病、腸閉塞、上腹部痛、小腸炎、大腸穿孔、蜂巣炎、腫脹各1例は、治験薬との因果関係が否定できないと判断された。投与中止に至った有害事象は、プラセボ群4.7%(10/211例)、オンボー®群2.4%(15/630例)、ウステキヌマブ群0.3%(1/309例)に認められ、その事象は表のとおりであった。
例数(%)(クローン病以外の重篤な有害事象及びクローン病以外の投与中止に至った有害事象は除く)、安全性解析対象集団(mITT集団)※
- a プラセボ群のノンレスポンダー1例(12週でオンボー® 投与に移行)は含まない。
- b 12週までの治験薬の投与中止
- ※安全性解析対象集団はmITT集団と同じ集団。無作為割付され、1回以上の治験薬投与を受けたすべての患者。割付された治験薬を使用しなかった患者、正しい治験薬を使用しなかった患者、治験実施計画書を遵守しなかった患者を含む。
<投与期全体>
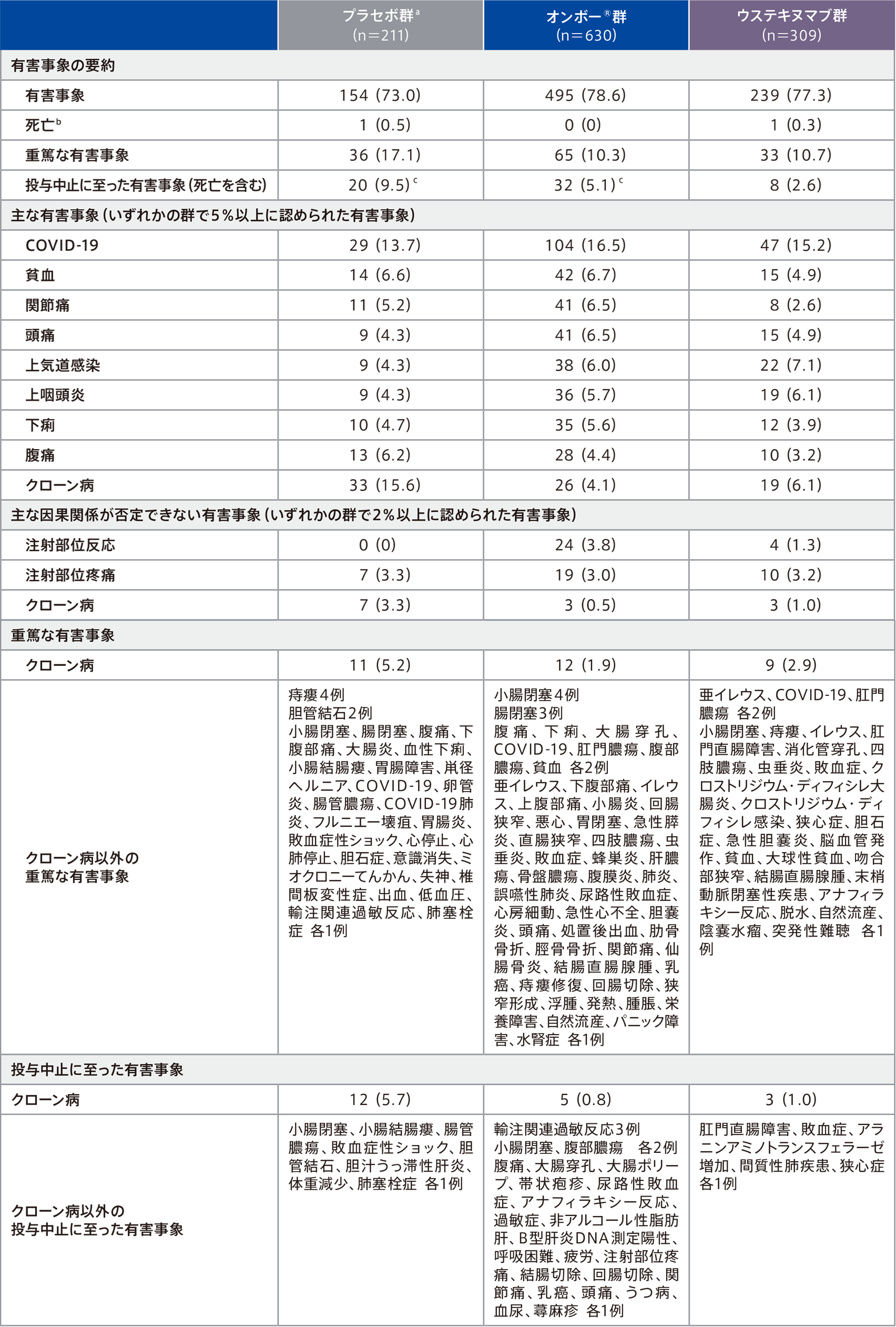
投与期全体での有害事象は、プラセボ群73.0%(154/211例)、オンボー®群78.6%(495/630例)、ウステキヌマブ群77.3%(239/309例)に認められ、主な有害事象(いずれかの群で5%以上に認められた有害事象)は下表のとおりであった。
因果関係が否定できない有害事象は、プラセボ群20.4%(43/211例)、オンボー®群32.5%(205/630例)、ウステキヌマブ群24.3%(75/309例)に認められ、2%以上に認められた因果関係が否定できない有害事象は下表のとおりであった。
本試験中に3例〔第1期(0~12週)のプラセボ群1例(心停止/肺塞栓症)、第2期(12~52週)のウステキヌマブ群1例(敗血症)、第2期(12~52週)のオンボー®投与に移行したプラセボ群1例(クローン病)〕に死亡が報告され、治験担当医師により治験薬との因果関係はないと判断された。
重篤な有害事象は、プラセボ群17.1%(36/211例)、オンボー®群10.3%(65/630例)、ウステキヌマブ群10.7%(33/309例)に認められ、その事象は下表のとおりであった。このうち、プラセボ群のクローン病2例、痔瘻、腸閉塞、大腸炎、血性下痢、胃腸障害、腸管膿瘍、出血、輸注関連過敏反応 各1例、オンボー®群のクローン病2例、腸閉塞、大腸穿孔、上腹部痛、小腸炎、虫垂炎、蜂巣炎、貧血、関節痛、腫脹、自然流産 各1例、ウステキヌマブ群のクローン病3例、痔瘻、肛門膿瘍、クロストリジウム・ディフィシレ感染 各1例は、治験薬との因果関係が否定できないと判断された。
投与中止に至った有害事象は、プラセボ群9.5%(20/211例)、オンボー®群5.1%(32/630例)、ウステキヌマブ群2.6%(8/309例)に認められ、その事象は下表のとおりであった。
例数(%)(クローン病以外の重篤な有害事象及びクローン病以外の投与中止に至った有害事象は除く)、安全性解析対象集団(mITT集団)※
- a プラセボ群に割り付けられた患者のうちプラセボを投与した期間の患者のみ含む。
- b プラセボ群のノンレスポンダー1例(12週でオンボー® 投与に移行)は含まない。
- c プラセボ群の2例及びオンボー®群の2例は、第1期(0~12週)に発現が認められた有害事象により、第2期(12~52週)に投与を中止した。
- ※安全性解析対象集団はmITT集団と同じ集団。無作為割付され、1回以上の治験薬投与を受けたすべての患者。割付された治験薬を使用しなかった患者、正しい治験薬を使用しなかった患者、治験実施計画書を遵守しなかった患者を含む。