- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Clinical Study(クローン病)「クローン病」に対する効果 ウステキヌマブとの比較
 Clinical Study(クローン病)「クローン病」に対する効果
Clinical Study(クローン病)「クローン病」に対する効果
ウステキヌマブとの比較
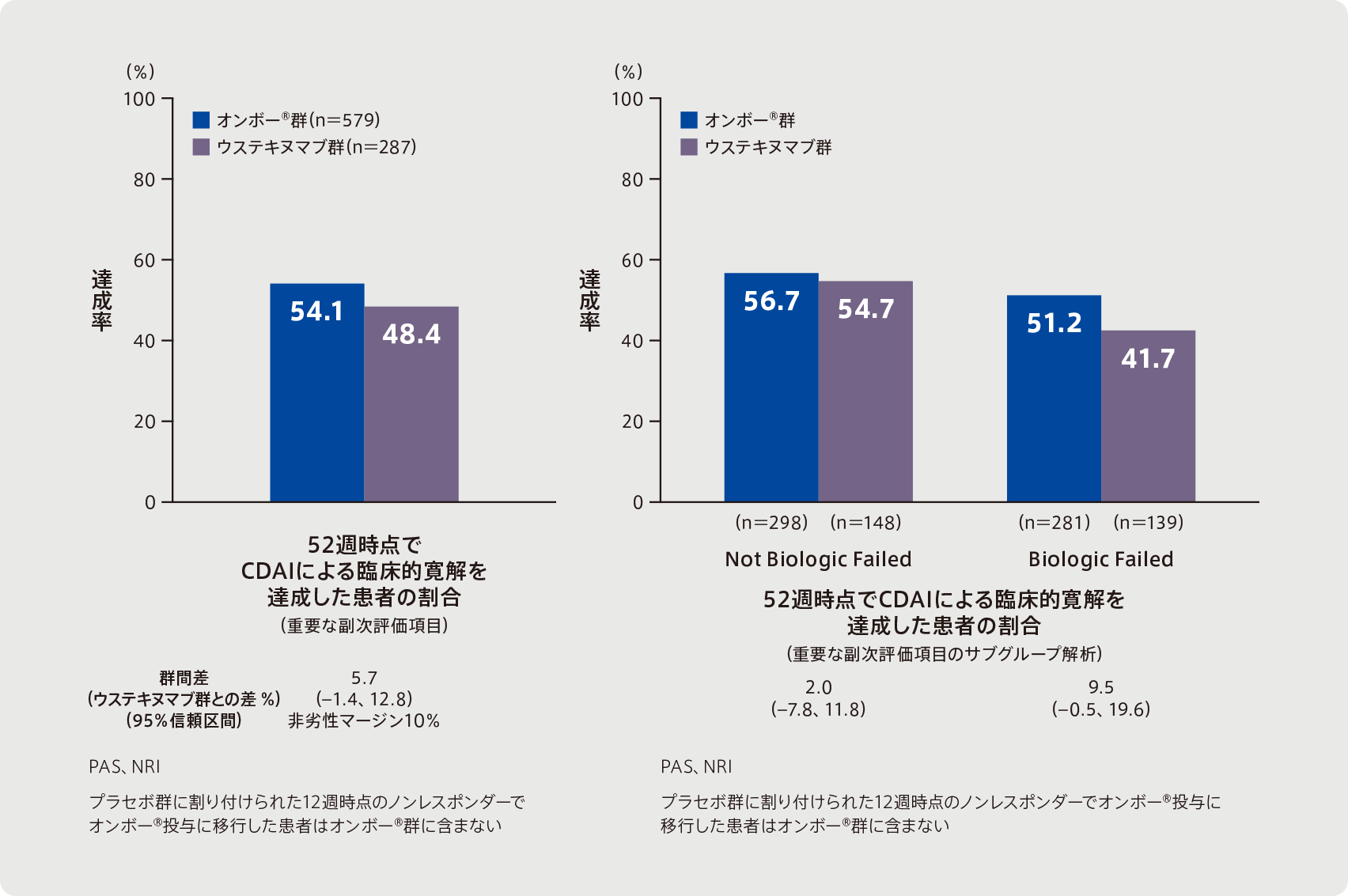
●52週時点でCDAIによる臨床的寛解を達成した患者の割合
(重要な副次評価項目)(重要な副次評価項目のサブグループ解析)
重要な副次評価項目である52週時点でCDAIによる臨床的寛解を達成した患者の割合は、オンボー®群では54. 1%(313/579例)であり、ウステキヌマブ群の48.4%(139/287例)に対するオンボー®群の非劣性が示された〔群間差(ウステキヌマブ群との差 %)(95%信頼区間)5.7(–1.4 、12.8)、非劣性マージン10%、多重性調整を実施〕。
サブグループ解析であるNot Biologic Failed及びBiologic Failedにおける結果は以下のとおりであった。
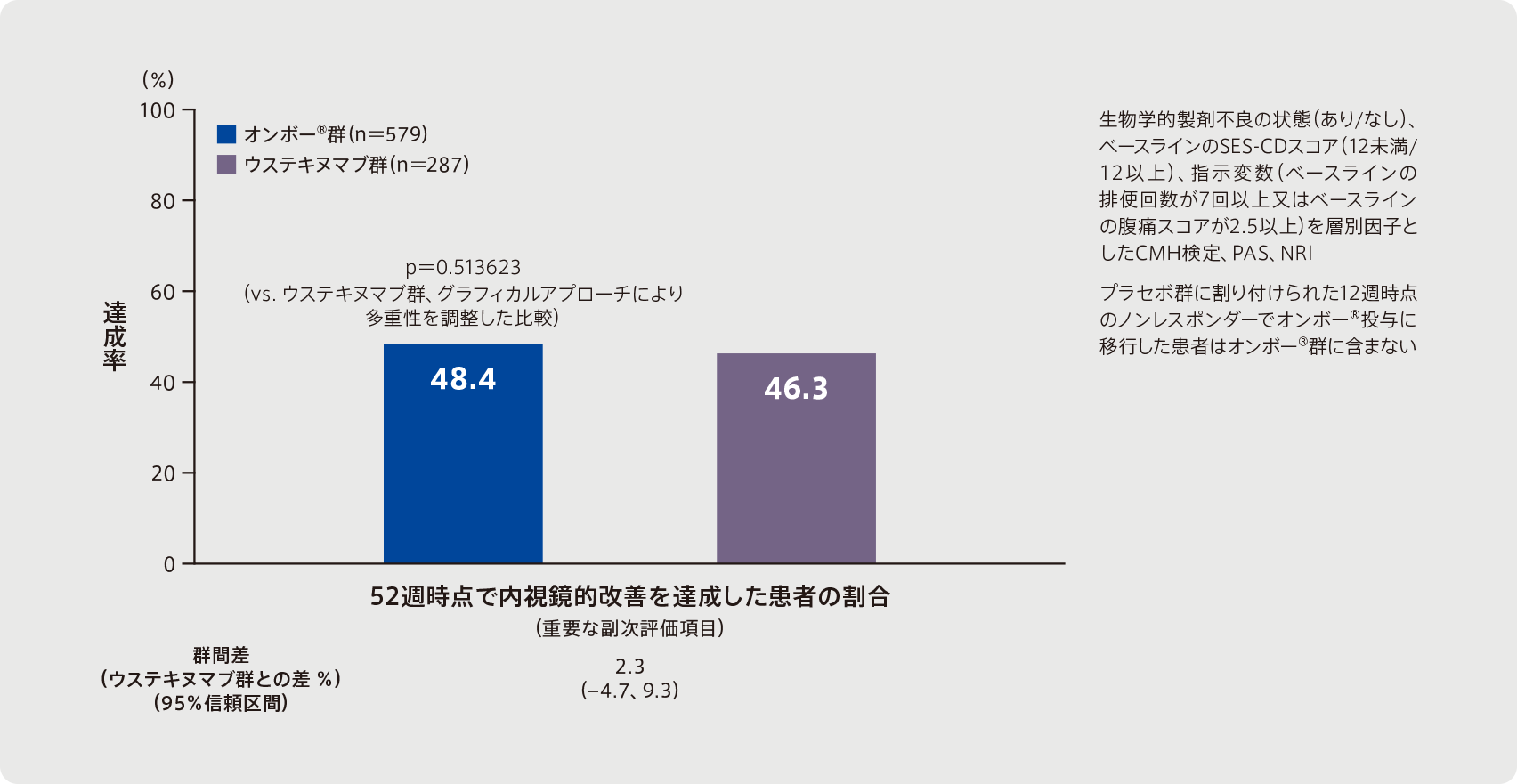
●52週時点で内視鏡的改善を達成した患者の割合
(重要な副次評価項目)
重要な副次評価項目である52週時点で内視鏡的改善を達成した患者の割合は、オンボー®群では48.4%(280/579例)であり、ウステキヌマブ群の46.3%(133/287例)に対するオンボー®群の優越性は示されなかった〔群間差(ウステキヌマブ群との差 %)(95%信頼区間)2.3(–4.7、9.3)、p=0.513623、CMH検定、多重性調整を実施〕。
●52週時点で内視鏡的改善かつCDAIによる臨床的寛解を達成した患者の割合
(その他の副次評価項目)
その他の副次評価項目である52週時点で内視鏡的改善かつCDAIによる臨床的寛解を達成した患者の割合は、オンボー®群では34.4%(199/579例)であり、ウステキヌマブ群の27.9%(80/287例)と比較して有意に高いことが示された〔群間差(ウステキヌマブ群との差 %)(95%信頼区間)6.8(0.4、13.2)、p<0.05、CMH検定、多重性を調整していない比較〕。
ウステキヌマブ皮下注のクローン病に対しての国内で承認された用法及び用量
ウステキヌマブ(遺伝子組換え)の点滴静注製剤を投与8週後に、通常、成人にはウステキヌマブ(遺伝子組換え)として90mgを皮下投与し、以降は12週間隔で90mgを皮下投与する。なお、効果が減弱した場合には、投与間隔を8週間に短縮できる。