- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ・パロキセチン対照二重盲検比較試験(用量反応非劣性試験)(うつ病・うつ状態) 安全性
 Clinical Study第Ⅲ相プラセボ・パロキセチン対照二重盲検比較試験(用量反応非劣性試験)(うつ病・うつ状態)
Clinical Study第Ⅲ相プラセボ・パロキセチン対照二重盲検比較試験(用量反応非劣性試験)(うつ病・うつ状態)
安全性
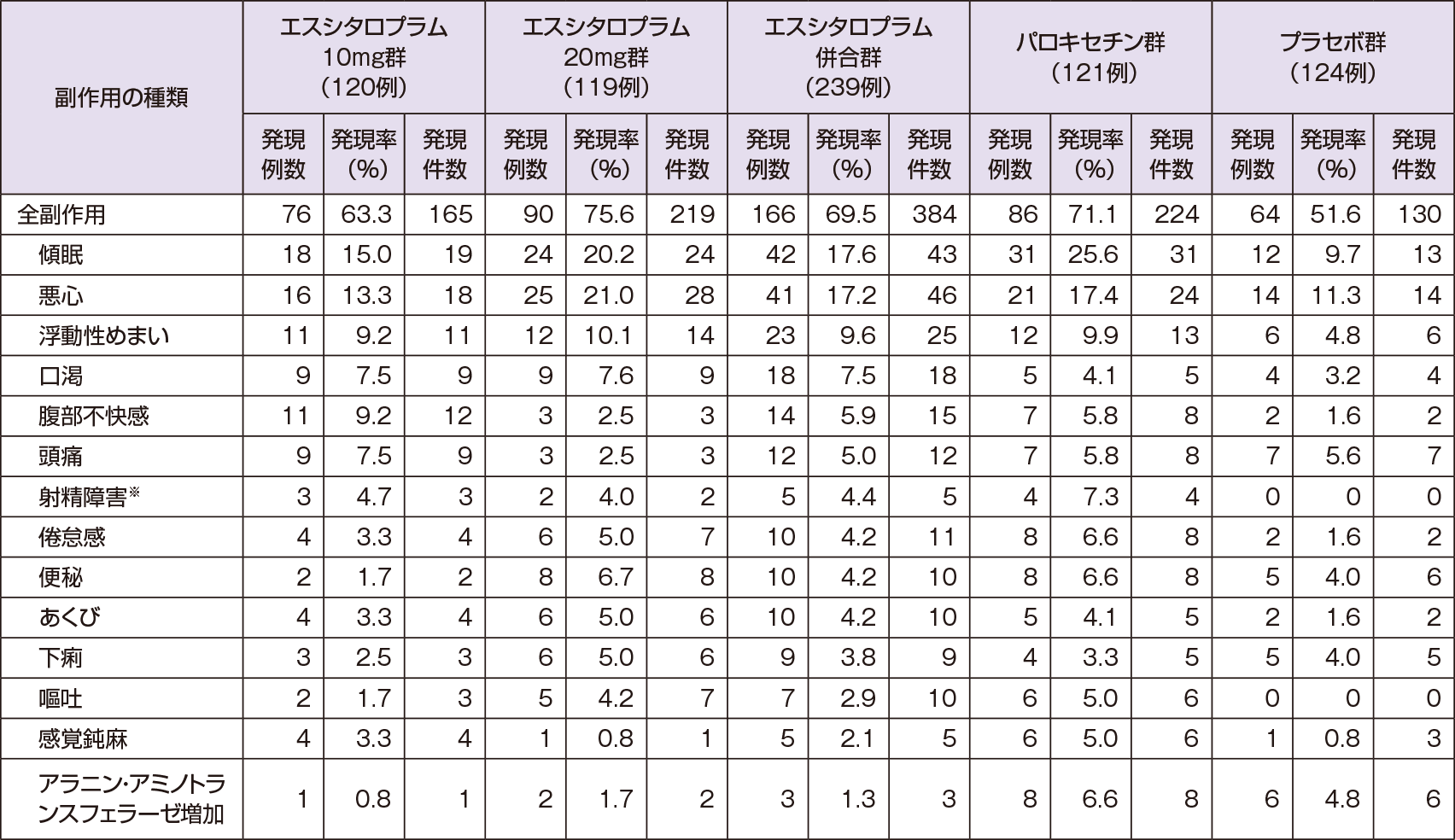
副作用
観察期及び後観察期の副作用は、エスシタロプラム10mg群120例中76例(63.3%)、エスシタロプラム20mg群119例中90例(75.6%)、エスシタロプラム併合群239例中166例(69.5%)、パロキセチン群121例中86例(71.1%)、プラセボ群124例中64例(51.6%)に認められた。いずれかの群で5%以上発現した副作用は下表の通りであった。重篤な副作用は、エスシタロプラム10mg群でうつ病・自殺企図1例(0.8%)、パロキセチン群で自殺念慮1例(0.8%)に認められたが、エスシタロプラム20mg群及びプラセボ群では認められなかった。投与中止に至った副作用は、エスシタロプラム10mg群で5例(4.2%)に8件(自律神経失調、腹部不快感、心室性期外収縮、心電図QT延長、胸部不快感、頭痛、嘔吐、肝機能異常)、エスシタロプラム20mg群で5例(4.2%)に11件(腹部不快感、食欲減退、呼吸障害、頭痛、冷汗、動悸、悪心、双極1型障害、浮動性めまい、無力症、入眠時幻覚)、パロキセチン群で3例(2.5%)に9件(頭痛、倦怠感、傾眠が各2件等)、プラセボ群で3例(2.4%)に3件(疼痛、易刺激性、椎間板突出)認められた。
- 副作用名はMedDRA/J ver12.1の基本語を用いて表示
- ※:男性のみの母数を用いた
割付登録以降の中止
割付登録以降の中止例は、エスシタロプラム10mg群120例中15例(12.5%)、エスシタロプラム20mg群119例中16例(13.4%)、エスシタロプラム併合群239例中31例(13.0%)、パロキセチン群121例中13例(10.7%)、プラセボ群124例中21例(16.9%)に認められた。有害事象による中止例は、エスシタロプラム10mg群6例、エスシタロプラム20mg群7例、エスシタロプラム併合群13例、パロキセチン群5例、プラセボ群3例に認められた。