- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Information:安全性
 Information
Information
安全性
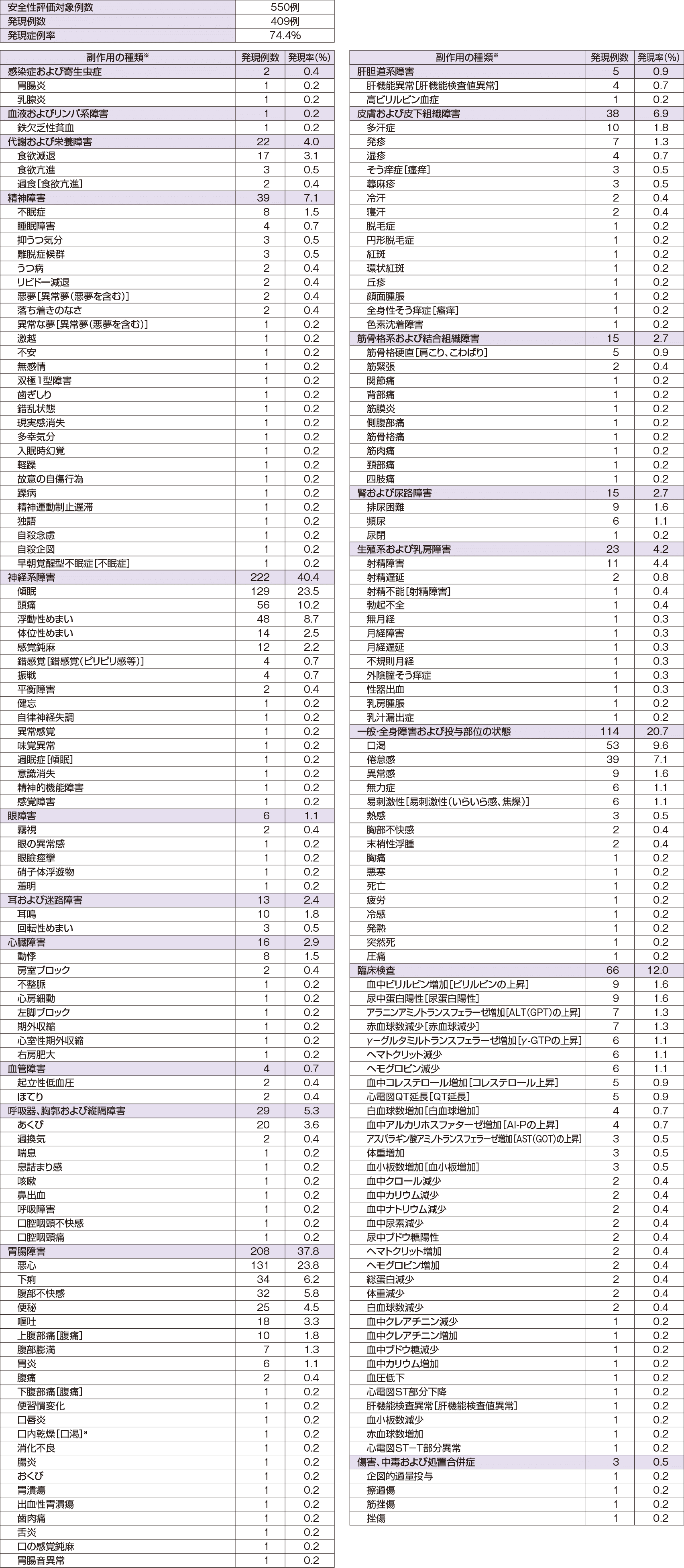
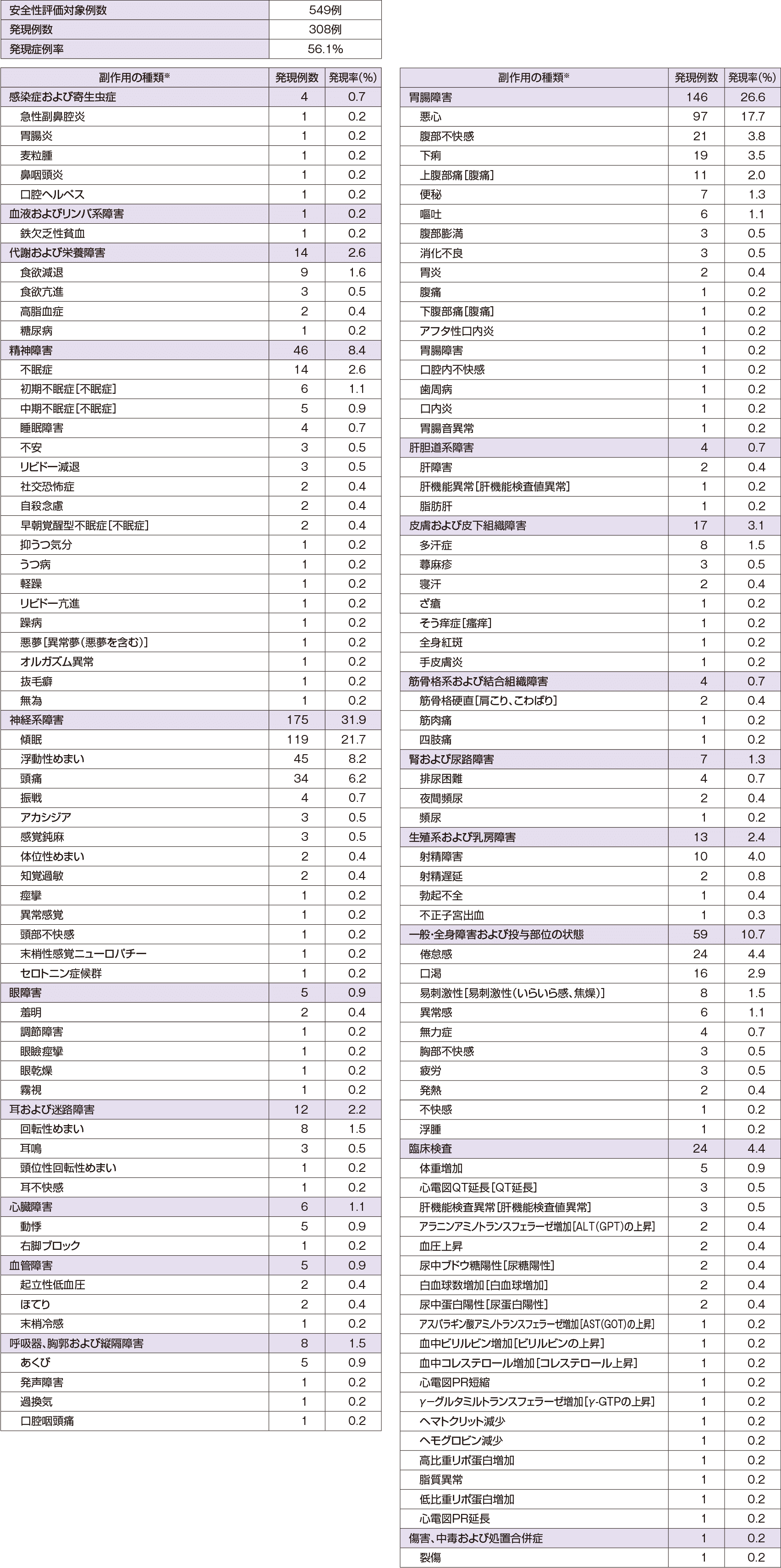
副作用
大うつ病性障害患者を対象とした国内臨床試験(4試験)及び社会不安障害患者を対象とした国内臨床試験(2試験)において、総症例1099例中、717例(65.2%)に臨床検査値異常を含む副作用が認められている。その主なものは傾眠248例(22.6%)、悪心228例(20.7%)、浮動性めまい93例(8.5%)、頭痛90例(8.2%)、口渇69例(6.3%)、倦怠感63例(5.7%)等であった。(承認時)
うつ病・うつ状態患者における製造販売後調査において、3703例中584例(15.8%)に臨床検査値異常を含む副作用が認められている。その主なものは悪心178例(4.8%)、傾眠101例(2.7%)、倦怠感36例(1.0%)等であった。(第6回安全性定期報告時)
- ※副作用の分類名、副作用名はMedDRA/J ver16.0の器官別大分類、基本語を用いて表示。
- [ ]内の表記は、添付文書で使用している副作用名。
- 性別特有有害事象については、男性252例、女性298例を分母に用いた。
- a:添付文書「その他の副作用」項では口内乾燥は口渇として扱った。
- ※副作用の分類名、副作用名はMedDRA/J ver16.0の器官別大分類、基本語を用いて表示。
- [ ]内の表記は、添付文書で使用している副作用名。
- 性別特有有害事象については、男性252例、女性297例を分母に用いた。